Development of a duplex real-time fluorescent quantitative PCR assay for simultaneous detection of white spot syndrome virus and shrimp reference gene
-
摘要:背景
白斑综合征病毒(WSSV)是一种高度传染性和致命性的病原体,对全球虾类养殖业构成重大威胁。WSSV可通过水平传播和垂直传播迅速扩散,虾在感染WSSV 3~10 d内累积死亡率最高可达到100%。由于缺乏有效的预防和治疗措施,开发快速、准确和敏感的WSSV检测技术对及时诊断和实施控制措施至关重要。
目的建立一种WSSV和对虾内参基因双重荧光定量PCR检测方法,提高WSSV检测的灵敏度和特异性。
方法首先,基于WSSV基因组保守序列设计合成特异性引物和TaqMan探针,建立WSSV单重荧光定量PCR检测体系,经特异性和重复性试验证实,该方法对WSSV具有良好的特异性和重复性。在此基础上,设计合成凡纳滨对虾(Litopenaeus vannamei)内参基因引物和探针,并对引物碱基进行优化替换,建立WSSV−对虾内参基因双重荧光定量PCR检测体系。
结果敏感性试验结果显示,该双重检测体系对WSSV的检测下限可达15拷贝·µL−1,在6.6~6.6×105拷贝·µL−1范围内,WSSV质粒标准品的起始模板量对数值与循环阈值(Ct值)呈良好的线性关系(R2=
0.9930 )。同时,内参基因的引入可有效地区分样本中由核酸提取或操作问题引起的假阴性结果。结论综上所述,本研究建立的WSSV−对虾内参基因双重荧光定量PCR检测方法灵敏度高、特异性强、重复性好,可为WSSV的快速诊断及流行病学调查提供可靠的技术手段,对控制WSSV的暴发流行、保障对虾养殖业的可持续发展具有重要意义。
-
关键词:
- 白斑综合征病毒(WSSV) /
- 荧光定量PCR /
- TaqMan探针 /
- 病毒检测 /
- 水产养殖
Abstract:IntroductionThe white spot syndrome virus (WSSV) is a highly infectious and lethal pathogen that poses a significant threat to the global shrimp farming industry. WSSV can spread rapidly through both horizontal and vertical transmission, leading to mortality rates of up to 100% within 3−10 days post-infection. Due to the absence of effective prevention and treatment measures, developing rapid, accurate, and sensitive detection technologies for WSSV is crucial for timely diagnosis and implementation of control measures to prevent disease spread.
ObjectiveThis study aimes to establish a sensitive and specific duplex real-time fluorescent quantitative PCR (qPCR) method for the simultaneous detection of WSSV and an endogenous control gene in shrimp.
MethodsFirst, specific primers and TaqMan probes were designed based on the conserved sequences of the WSSV genome, establishing a single WSSV qPCR detection system. Specificity and repeatability tests confirmed that the method had excellent specificity for WSSV without cross-reactivity, with the coefficient of variation for different gradients of plasmid standards being less than 1.5%, indicating high repeatability. Subsequently, primers and probes for the endogenous control gene of Litopenaeus vannamei were designed and synthesized, and the primer sequences were optimized to establish a duplex qPCR detection system.
ResultsSensitivity tests revealed that the detection limit of the duplex system for WSSV was 15 copies·µL−1, with a strong linear relationship between the logarithmic value of the initial template amount and the cycle threshold (Ct) value of WSSV plasmid standards within the range of 6.6 to 6.6×105 copies·µL−1(R²=0.998). Furthermore, the incorporation of the endogenous control gene effectively distinguished false-negative results caused by nucleic acid extraction or operational issues in the samples.
ConclusionIn conclusion, the established duplex qPCR detection method for WSSV and the shrimp endogenous control gene exhibits high sensitivity, strong specificity, and good repeatability. This method provides a reliable technical approach for the rapid diagnosis and epidemiological investigation of WSSV, which is crucial for controlling WSSV outbreaks and ensuring the sustainable development of the shrimp farming industry.
-
白斑综合征病毒(White spot syndrome virus,WSSV)属于线头病毒科(Nimaviridae)、白斑病毒属(Whispovirus)的唯一成员,是一种快速复制、毒性极强的虾病原体,会引发水生动物严重的综合性传染性疾病[1]。该病毒粒子包被双层囊膜,基因组为环状、双链DNA,大小约为300 kb,预测编码约180种蛋白,是目前已知最大基因组的无脊椎动物病毒之一[2-3]。
WSSV的宿主范围广泛,包括所有养殖和野生的海洋虾蟹、虾蛄和淡水虾等[4-6]。WSSV可通过水平传播和垂直传播,侵染对虾的鳃、肝胰腺、外壳等组织,引起白斑综合征(White spot disease,WSD),导致患病对虾甲壳出现白色钙化斑点。WSSV传播迅速、致病性强、致死率高,导致宿主在感染3~10 d内的累积死亡率最高可达到100%[7-9],给全世界对虾养殖业造成巨大的经济损失。
1992年,白斑综合征暴发于中国台湾地区,此后迅速传播至整个亚洲及欧美的主要对虾养殖地区,引起全球性对虾流行病,给对虾养殖业造成了重大损失[10]。1995年世界动物卫生组织、联合国粮农组织和亚太地区水产养殖发展网络中心同时将WSSV列为需要监测的重要水生动物疫病病原。2009年,中国农业部公告第1125号《一、二、三类动物疫病病种名录》将WSSV列为水生生物一类动物疫病病毒。目前,尚未发现有效的防治药物,开发新的、操作简单快速、准确度高和灵敏性高的WSSV检测技术,加强对无特定病原亲虾及产生的幼虾、成虾携带感染情况的实时监测,从而在疫病流行早期阶段及时做出诊断,并采取隔离措施是控制WSSV传播的关键,对预防和降低WSD的暴发,保障中国对虾养殖业的持续健康发展具有重要意义[11]。
聚合酶链式反应(Polymerase chain reaction,PCR)体外快速扩增特定基因技术,最早被应用于β-珠蛋白基因的扩增和镰状细胞贫血的诊断分析,此后在分子生物学、医学研究、疾病诊断等领域得到了迅速的应用和发展[12]。1996年,美国应用生物系统公司推出荧光定量PCR(Real-time fluorescent quantitative polymerase chain reaction,qPCR)技术,实现了PCR从定性到定量的飞跃。荧光定量PCR技术是将荧光基团加入到PCR反应体系中,并在实验过程中,通过对荧光信号积累实时监测整个PCR反应的进程,再根据得到的标准曲线对未知的模板进行定量的分析[13]。该技术主要包括染料结合、杂交探针、水解探针、荧光标记引物以及分子信标等方法[14];其中,TaqMan水解探针法因特异性高且能进行多重反应,被广泛应用于基因的定量检测中,在荧光定量PCR技术市场中占据重要的位置,成为了不可缺少的病原体检测手段,对于水生动物疫病的防控具有重要的意义[15]。
目前,国内尚未发布WSSV荧光定量检测的相关标准,农业农村部在WSD诊断规程中仍推荐采用套氏PCR。然而,在实际工作中,该方法存在检测时间长、操作复杂繁琐、容易污染和不能定量等缺点,无法满足对WSSV进行快速定量的检测需求。本研究基于荧光定量PCR技术,建立WSSV TaqMan荧光定量PCR检测方法,并建立同时检测WSSV和对虾内参基因的多重荧光定量PCR检测方法,旨在为苗种检疫、生产检测、水产养殖病害防控和流行病学分析提供技术支持。
1. 材料与方法
1.1 实验材料
1.1.1 样品来源
虾WSD阳性样品为本实验室攻毒试验收集的患WSD的凡纳滨对虾(Litopenaeus vannamei),经PCR检测并测序后,确认为WSD感染。WSSV阳性样品、传染性皮下及造血组织坏死病毒阳性样品(Infectious hypodermal and hematopoietic necrosis virus,IHHNV)、肝肠胞虫阳性样品(Enterocytozoon hepatopenaei,EHP)、对虾急性肝胰腺坏死病阳性样品(Acute hepatopancreatic necrosis disease,AHPND)、虾血细胞虹彩病毒阳性样品(Shrimp hemocyte iridescent virus,SHIV)、副溶血弧菌阳性样品(Vibrio parahemolyticus,VP)、虾核酸(凡纳滨对虾总核酸)、细胞肿大虹彩病毒阳性样品、斜带石斑鱼神经坏死病毒(Nervous necrosis virous,NNV)阳性样品和鱼核酸(斜带石斑鱼总核酸)等均由本实验室保存。pMD18-WSSV重组质粒(插入GenBank中白斑综合征病毒基因MG264599.1片段)由本实验室保存。
1.1.2 主要试剂
2×TaqProbe qPCR Mastermix购自生工生物工程(上海)股份有限公司;DNA提取试剂盒购自天根生化科技(北京)有限公司;序列合成和DNA测序委托生工生物工程(上海)股份有限公司完成;其余试剂均为国产或进口分析纯。
1.1.3 主要仪器
荧光定量PCR仪(Gentier 48E型全自动PCR分析系统)为西安天隆科技有限公司产品。
1.2 对虾DNA提取及PCR检测
分别取患WSD的凡纳滨对虾样品和健康凡纳滨对虾鳃部组织约20 mg,参照天根基因组DNA提取试剂盒说明书提取DNA,−20 ℃保存备用。并以此为模板,参照GB/T 28630.2—2012《白斑综合征(WSD)诊断规程》中的套式PCR检测法,同时以双蒸水作为空白对照进行PCR扩增[16]。
1.3 WSSV和凡纳滨对虾内参基因引物、探针的设计
1.3.1 WSSV
根据GenBank中WSSV基因,序列号分别为:MG264599.1、MF768985.1、KT995471.1、KR083866.1、AF332093.3、AF440570.1、KY827813.1、AF369029.2,通过比对它们的保守序列,采用Primer Premier 5.0和Primer Express 3.0软件设计虾WSSV特异性引物和TaqMan探针。引物与探针均由生工生物工程(上海)股份有限公司合成。经过试验初筛,参照20 µL实时荧光定量PCR 反应体系:模板 5 µL,上、下游引物各0.2 µmol·L−1、qPCR MasterMix 10 µL,探针0.04 µmol·L−1。PCR条件:95 ℃ 5 min;95 ℃ 10 s、60 ℃ 30 s、35 ℃ 30 s,共40个循环[17],同时以双蒸水作为空白对照进行PCR扩增。选择一套效果较好的引物及探针,用于WSSV荧光定量PCR检测。引物序列:WSSV-F1(GGAAACGGTAACGAATCTGAA),WSSV-R1(TGAGCGTTCATTGTGCTCTT),荧光定量PCR特异性扩增片段的大小为81 bp,TaqMan探针5’端标记荧光基团FAM,3’端标记猝灭基团BHQ1,探针WSSV-P1为5’FAM-TCCAGAATGCTCTGCCAAGGAACAGA-BHQ1-3’。
1.3.2 凡纳滨对虾18S内参基因
根据凡纳滨对虾序列,采用Primer Premier 5.0和Primer Express 3.0软件,设计对虾18S内参基因特异性引物和TaqMan探针。引物与探针均由生工生物工程(上海)股份有限公司合成。经过试验初筛,选择一套效果较好的引物及探针,用于对虾18S内参基因荧光定量PCR检测。引物序列:Lv-18S-F3:TACAATGGCTATCACGGGTAA,Lv-18S-R3:CGCCTGCTGCCTTCCTTA,荧光定量PCR特异性扩增片段的大小为93 bp,TaqMan探针5’端标记荧光基团HEX,3’端标记猝灭基团BHQ1,探针Lv-18S-P3为:5’HEX-TTCTCAGGCTCCCTCTCCGGAAT-BHQ1-3’。
1.3.3 凡纳滨对虾18S内参基因引物碱基位点替换优化
在1.3.2凡纳滨对虾18S内参基因引物序列基础上,对对虾18S内参基因引物序列的碱基位点进行替换优化,由生工生物工程(上海)股份有限公司合成。经过试验初筛,选择一套效果较好的引物及探针,用于后续与WSSV引物组合建立双重荧光定量PCR检测方法。引物序列:Lv-18S-F3-T1:TACAATGGCTATCACGGGTAG,Lv-18S-R3-T3:CGCCTGCTGCCTTCCTGG。
1.4 标准曲线建立
将WSSV重组质粒进行10倍梯度稀释,使其浓度(Concentration,C)依次为6.6×105、6.6×104、6.6×103、6.6×102、6.6×10、6.6拷贝·µL−1后,作为标准品模板,采用1.3所述的方法,分别进行荧光定量PCR检测;利用数据分析软件进行分析,建立起始模板拷贝数(x)对数(logC)与循环阈值(Cycle threshold,Ct值)(y)间的标准曲线和线性回归方程。
1.5 特异性试验
分别以WSSV、IHHNV、EHP、AHPND、SHIV、VP、细胞肿大虹彩病毒、NNV等阳性样品,虾核酸(凡纳滨对虾总核酸)和鱼核酸(斜带石斑鱼总核酸)等为模板扩增,以双蒸水作为空白对照,进行荧光定量PCR检测,判断引物是否有非特异性扩增,以WSSV质粒标准模板为阳性对照,评价引物特异性。
1.6 建立WSSV和凡纳滨对虾内参基因双重检测方法
在已建立的WSSV实时荧光定量检测方法的基础上,分别与碱基位点替换前的凡纳滨对虾内参基因引物和碱基位点替换优化后的凡纳滨对虾内参基因引物结合组成双重荧光定量PCR,根据扩增反应的Ct值和扩增曲线的相对荧光强度值(Relative Fluorescence unit,RFU)选择最佳的双重组合。
1.7 敏感性试验
采用健康凡纳滨对虾核酸代替双蒸水对WSSV核酸样品进行10倍浓度梯度稀释,并以此为模板(浓度依次为1.5×105、1.5×104、1.5×103、1.5×102、1.5×10、1.5、0.15拷贝·µL−1)分别进行荧光定量PCR检测,根据扩增结果判断该双重检测方法的敏感性。
1.8 重复性试验
将重组质粒进行10倍浓度梯度稀释,利用建立的TaqMan荧光定量PCR检测方法进行检测,每个浓度重复3次,进行批内试验。并选3个不同的样品进行3次批间试验,分别进行TaqMan荧光定量PCR检测。根据检测的Ct值,分别计算其平均值、标准差及其变异系数,判断该反应体系检测方法的稳定性。
1.9 临床样本的检验
对临床采集的12份样品,同时应用建立的TaqMan荧光定量PCR检测方法和农村农业部在GB/T 28630.2—2012《白斑综合征(WSD)诊断规程》中推荐采用的套氏PCR检测方法进行WSSV检测,将结果进行比对,比较二者的符合率。
2. 结果与分析
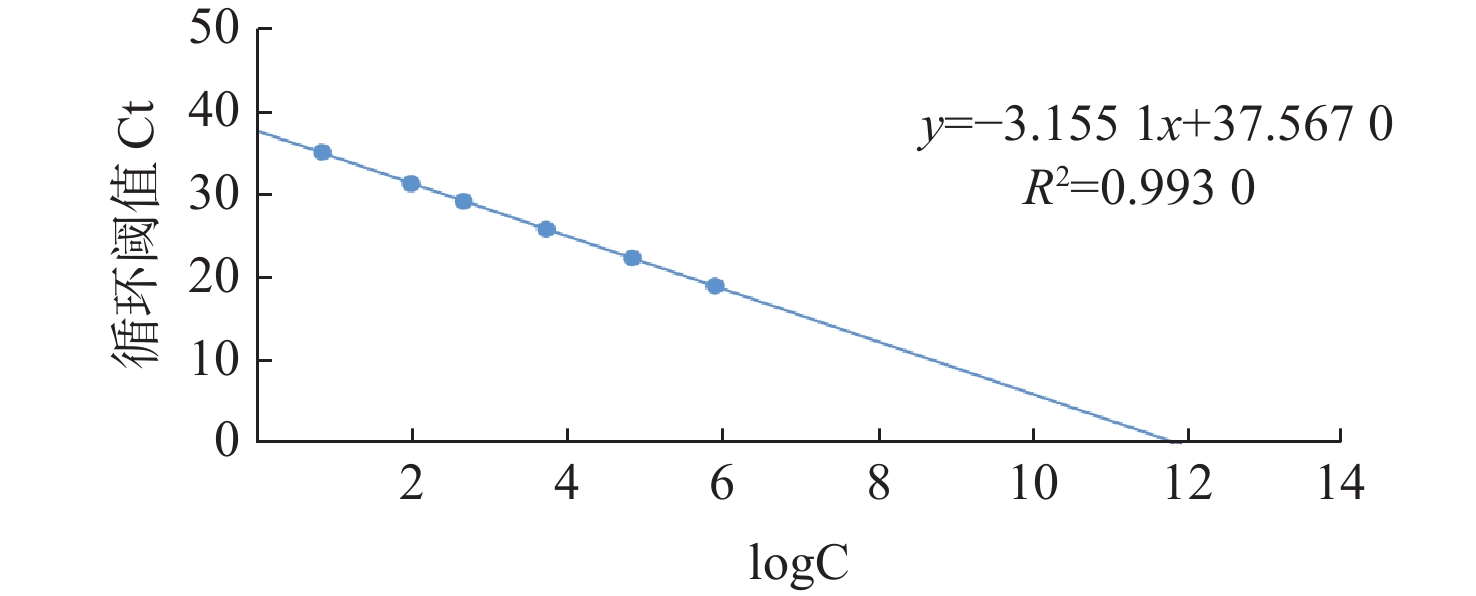
2.1 荧光定量PCR标准曲线的绘制
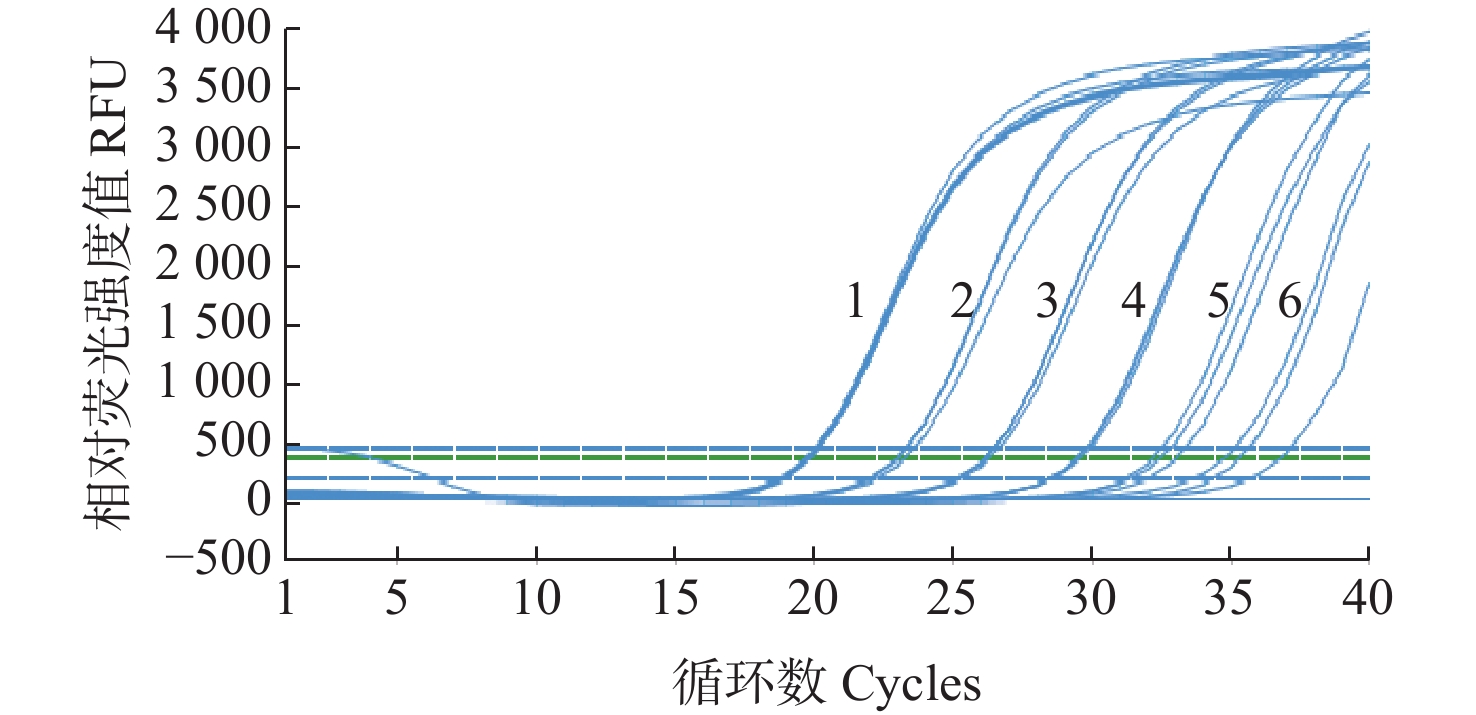
对10倍梯度稀释的质粒标准模板进行荧光定量PCR扩增,绘制Ct值与标准模板拷贝数对数值(logC)之间线性关系的标准曲线。结果如图1显示,质粒标准模板在6.6~6.6×105拷贝·µL−1范围内,均出现明显的荧光信号,Ct值在20~36之间。经数据分析建立标准曲线(图2),对应的线性回归方程Ct=−
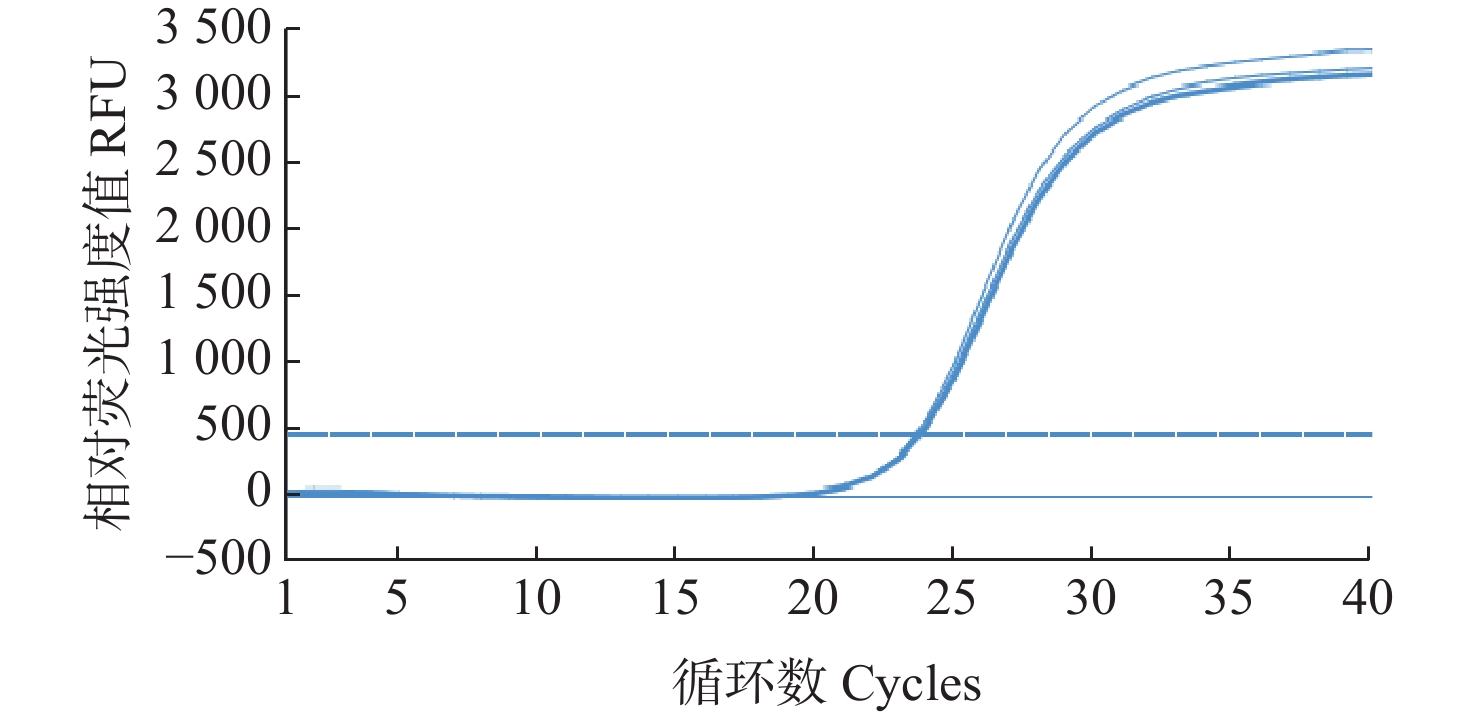
3.1551 logC+37.5670 ,相关系数R2=0.9930 ,表明Ct值与标准模板拷贝数对数值(logC)之间呈良好的线性关系,建立的WSSV荧光定量PCR反应体系稳定。![]() 图 1 pMD18-WSSV重组质粒的荧光定量PCR扩增曲线注:1为6.6×105拷贝·µL−1;2为6.6×104拷贝·µL−1;3为6.6×103拷贝·µL−1;4为6.6×102拷贝·µL−1;5为6.6×101 拷贝·µL−1;6为6.6拷贝·µL−1。Figure 1. Amplification plot of qPCR for pMD18-WSSV recombinant plasmidNotes: 1 means 6.6×105 copies·µL−1; 2 means 6.6×104 copies·µL−1; 3 means 6.6×103 copies·µL−1; 4 means 6.6×102 copies·µL−1; 5, 6 mean 6.6×101, 6.6 copies·µL−1, respectively.
图 1 pMD18-WSSV重组质粒的荧光定量PCR扩增曲线注:1为6.6×105拷贝·µL−1;2为6.6×104拷贝·µL−1;3为6.6×103拷贝·µL−1;4为6.6×102拷贝·µL−1;5为6.6×101 拷贝·µL−1;6为6.6拷贝·µL−1。Figure 1. Amplification plot of qPCR for pMD18-WSSV recombinant plasmidNotes: 1 means 6.6×105 copies·µL−1; 2 means 6.6×104 copies·µL−1; 3 means 6.6×103 copies·µL−1; 4 means 6.6×102 copies·µL−1; 5, 6 mean 6.6×101, 6.6 copies·µL−1, respectively.2.2 荧光定量PCR引物特异性检测
以常见病原WSSV、IHHNV、EHP、AHPND、SHIV、VP、细胞肿大虹彩病毒、NNV等阳性样品,虾核酸(凡纳滨对虾总核酸)和鱼核酸(斜带石斑鱼总核酸)的核酸为模板进行检测,结果显示只有WSSV出现扩增曲线(图3),Ct值分别为23.81、23.68和23.61;而其他病原阳性样品及阴性对照(健康虾总核酸)、空白对照均未检测到荧光信号,没有非特异性扩增,判为阴性。说明设计的引物和探针对WSSV检测具有良好的特异性。
2.3 对虾18S内参基因引物碱基位点替换
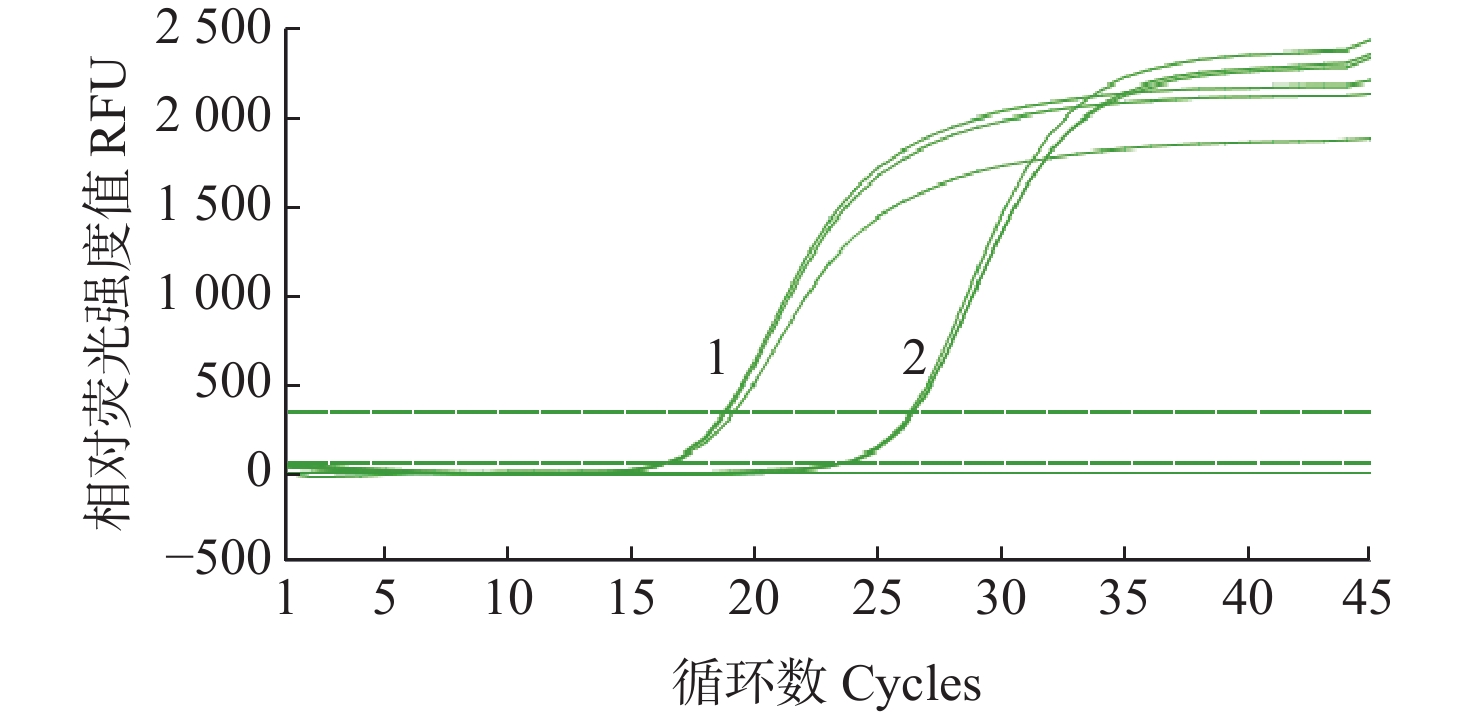
对虾内参基因引物碱基位点替换前、后的荧光定量扩增对比结果如图4所示,对虾内参基因引物碱基位点替换后的扩增反应的Ct值从16.37、16.57和16.47升高至26.4、26.51和26.34;而扩增曲线的ΔRn未见下降,且略有增强;将用于后续双重荧光定量PCR试验组合。
2.4 双重荧光定量PCR检测方法的建立
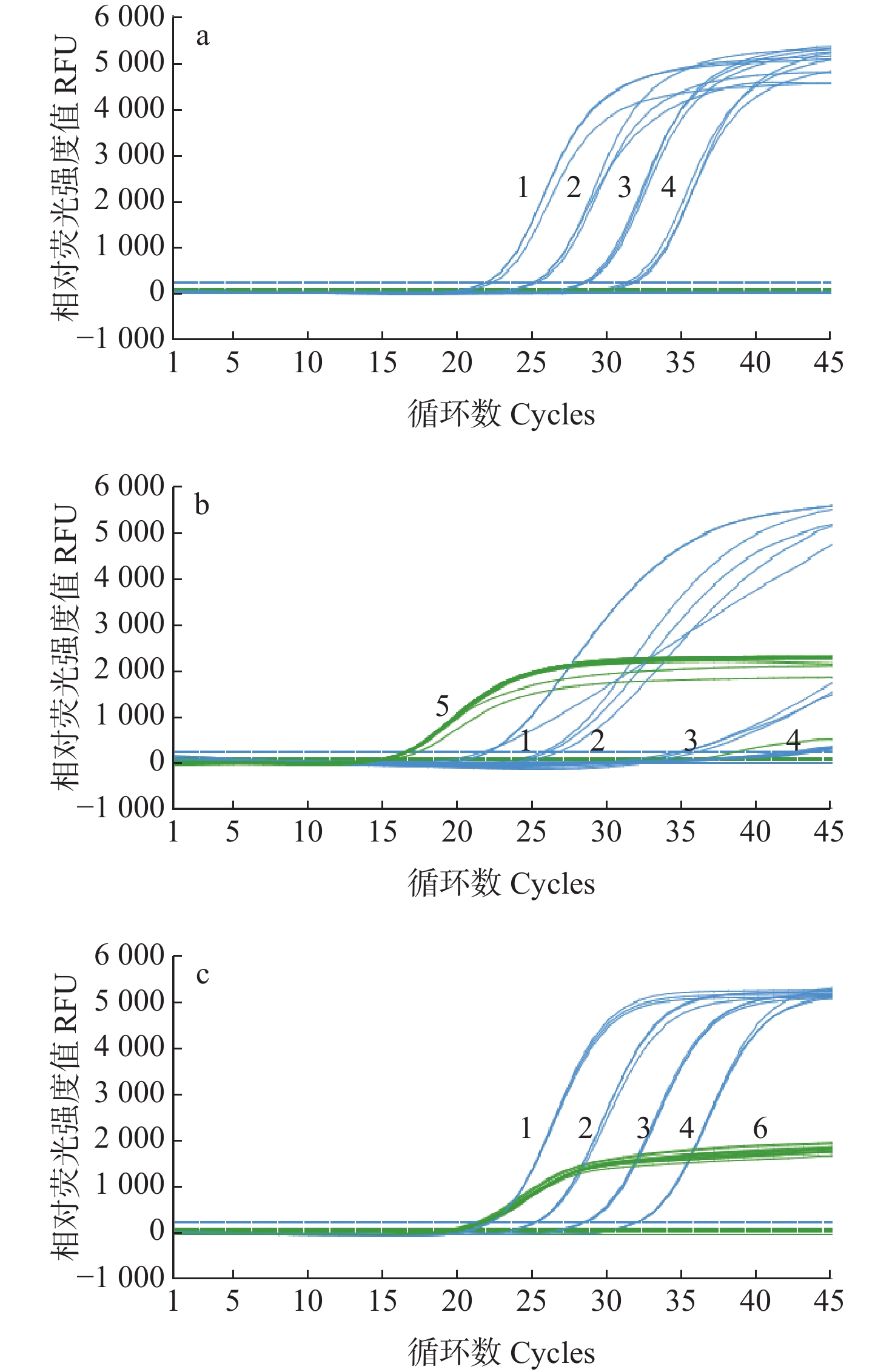
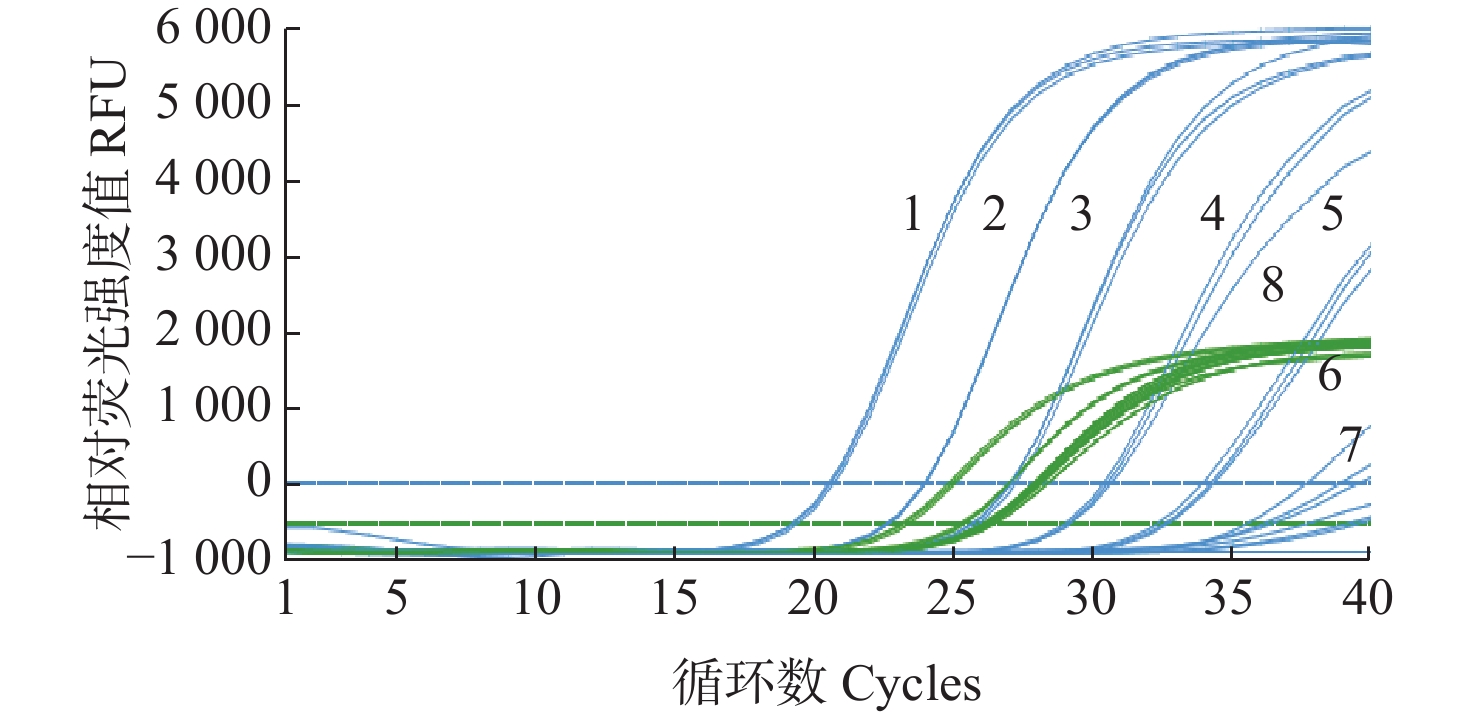
利用健康凡纳滨对虾核酸代替双蒸水,对WSSV核酸样品进行10倍浓度梯度稀释,并以此为模板,分别进行单重WSSV荧光定量检测、WSSV−对虾内参基因双重荧光定量检测和WSSV−对虾内参基因碱基位点替换双重荧光定量检测。结果显示(图5a和图5b),当使用优化前的对虾内参基因引物进行双重PCR检测时,WSSV基因检测的Ct值和ΔRn出现较大的变动,因此需要对筛选获得的对虾内参基因引物进行碱基位点替换优化。对虾内参基因引物碱基位点替换后,使用优化后的对虾内参基因引物进行双重PCR检测,结果显示WSSV基因检测的Ct值和ΔRn无明显变化(图5a和图5c),说明以优化后的对虾内参基因引物建立的双重荧光定量PCR方法不影响WSSV的检出。
![]() 图 5 WSSV−凡纳滨对虾18S rRNA双重荧光定量PCR扩增曲线注:a表示WSSV qPCR扩增曲线;b表示WSSV-18S rRNA qPCR扩增曲线;c表示WSSV-18S rRNA引物碱基位点替换 qPCR扩增曲线。1~4为WSSV荧光定量PCR扩增曲线;5为对虾18S内参基因引物PCR扩增曲线;6为对虾18S rRNA引物碱基位点替换PCR扩增曲线。Figure 5. The amplification curve of duplex qPCR for WSSV−18S rRNA of L.vannameiNotes: a means the amplification curve for WSSV; b means the amplification curve for WSSV-18S rRNA of L.vannamei; c means the amplification curve for WSSV-18S rRNA with primer's base site substitution of L.vannamei. 1−4 mean the amplification curve for WSSV; 5 means the amplification curve for 18S rRNA of L.vannamei; 6 means the amplification curve for WSSV-18S rRNA with primer’s base site substitution of L.vannamei.
图 5 WSSV−凡纳滨对虾18S rRNA双重荧光定量PCR扩增曲线注:a表示WSSV qPCR扩增曲线;b表示WSSV-18S rRNA qPCR扩增曲线;c表示WSSV-18S rRNA引物碱基位点替换 qPCR扩增曲线。1~4为WSSV荧光定量PCR扩增曲线;5为对虾18S内参基因引物PCR扩增曲线;6为对虾18S rRNA引物碱基位点替换PCR扩增曲线。Figure 5. The amplification curve of duplex qPCR for WSSV−18S rRNA of L.vannameiNotes: a means the amplification curve for WSSV; b means the amplification curve for WSSV-18S rRNA of L.vannamei; c means the amplification curve for WSSV-18S rRNA with primer's base site substitution of L.vannamei. 1−4 mean the amplification curve for WSSV; 5 means the amplification curve for 18S rRNA of L.vannamei; 6 means the amplification curve for WSSV-18S rRNA with primer’s base site substitution of L.vannamei.2.5 荧光定量PCR敏感性
以10倍梯度稀释的模板荧光定量PCR扩增,结果显示高浓度模板(1.5×104~1.5×105拷贝·µL−1)的扩增曲线呈典型的S形,低浓度模板(1.5×101~1.5×103拷贝·µL−1)的扩增曲线因未达扩增平台期而呈半S形,模板浓度为1.5拷贝·µL−1和0.15拷贝·µL−1各3个样品分别扩增出2和1条曲线,空白对照未出现任何扩增曲线(图6)。
![]() 图 6 荧光定量PCR的敏感性检测结果注:1为1.5×105拷贝·µL−1;2为1.5×104拷贝·µL−1;3为1.5×103拷贝·µL−1;4为1.5×102拷贝·µL−1;5为1.5×101拷贝·µL−1;6为1.5拷贝·µL−1;7为0.15拷贝·µL−1;8为凡纳滨对虾18S内参基因引物碱基位点替换PCR扩增曲线。Figure 6. Sensitivity of qPCRNotes: 1 means 1.5×105 copies·µL−1; 2 means 1.5×104 copies·µL−1; 3 means 1.5×103 copies·µL−1; 4 means 1.5×102 copies·µL−1; 5 means 1.5×101 copies·µL−1; 6 means 1.5 copies·µL−1; 7 means 0.15 copies·µL−1; 8 means the amplification curve for 18S rRNA with primer’s base site substitution of L. vannamei.
图 6 荧光定量PCR的敏感性检测结果注:1为1.5×105拷贝·µL−1;2为1.5×104拷贝·µL−1;3为1.5×103拷贝·µL−1;4为1.5×102拷贝·µL−1;5为1.5×101拷贝·µL−1;6为1.5拷贝·µL−1;7为0.15拷贝·µL−1;8为凡纳滨对虾18S内参基因引物碱基位点替换PCR扩增曲线。Figure 6. Sensitivity of qPCRNotes: 1 means 1.5×105 copies·µL−1; 2 means 1.5×104 copies·µL−1; 3 means 1.5×103 copies·µL−1; 4 means 1.5×102 copies·µL−1; 5 means 1.5×101 copies·µL−1; 6 means 1.5 copies·µL−1; 7 means 0.15 copies·µL−1; 8 means the amplification curve for 18S rRNA with primer’s base site substitution of L. vannamei.2.6 荧光定量PCR重复性检测
应用建立的TaqMan荧光定量PCR检测方法进行批内和批间重复试验,每个浓度梯度设置3个平行重复,根据试验取得的Ct值计算平均值、标准差和组内的变异系数。检测结果显示,批内和批间变异系数为0.24~1.46(表1和表2),满足qPCR对于批内和批间重复性要求。表明该检测方法具有良好的重复性,扩增结果稳定可靠。
表 1 白斑综合征病毒WSSV荧光定量PCR批内重复性检测Table 1. Intra-batch variability qPCR test of WSSV模板量/
(拷贝·µL−1)
Template amount/
(copies·µL−1)Ct均值
Mean Ct标准差
Standard
deviation变异系数/%
Coefficient of
variation6.6×103 22.25 0.21 0.93 6.6×102 25.71 0.38 1.46 6.6×101 29.05 0.32 1.09 表 2 白斑综合征病毒WSSV荧光定量批间重复性检测Table 2. Inter-batch variability qPCR test of WSSV模板量/
(拷贝·µL−1)
Template amount/
(copies·µL−1)Ct均值
Mean Ct标准差
Standard
deviation变异系数/%
Coefficient of
variation5.5×102 25.61 0.33 1.31 4.5×102 25.90 0.06 0.24 2.5×101 29.98 0.28 0.95 2.7 临床样品的检测
应用建立的TaqMan荧光定量PCR检测方法对12份临床样品进行检测,检出感染WSSV的样品7份;同时,与GB/T 28630.2—2012《白斑综合征(WSD)诊断规程》中的套氏PCR检测方法进行比对,2种方法的符合率为100%。
3. 讨论
WSSV可引发对虾白斑病,是全球虾类养殖中地理分布广、感染性强、传播速度快、发病时间短、致死率高、宿主范围广、危害最大的一种病毒,会对养殖业产生巨大的破坏,造成严重的经济损失。在对虾养殖业中,WSSV在个体间或群体间的水平传播较普遍,是主要的传播方式。发生对虾病的养殖场排出的废水、育苗时期购入的携带WSSV病毒的虾苗、运输过程中盛放感染WSSV病害水产品的设备等,均会造成WSSV大范围的水平传播。目前,尽管在该病毒的形态和基因组织结构等方面取得了显著的进展,但是仍无法有效地防控该病的发生并阻断其传播,只能早发现、早防疫,因此该病毒的快速检测至关重要。
至今,已建立了许多诊断WSSV的方法,包括传统组织学检测、目视检查法、生化检验法、电子显微镜技术、细胞培养方法、免疫学的酶联免疫吸附检测(Enzyme-linked immuno sorbent assay, ELISA)技术、分子生物学的环介导等温扩增(Loop-mediated isothermal amplification,LAMP)检测方法、核酸探针和PCR技术等。其中,多重PCR在同一反应体系中加入多对不同PCR引物和相应的模板,可在同一管反应中同时扩增出1条以上的目的基因,已经被广泛应用在植物病毒传播、烟草土传病害、动植物源成分、食品中的致病菌和病毒等方面的检测。多重PCR法较其他检测方法具有成本低、耗时较短、单次检测量大、灵敏度高、特异性好、线性范围宽且操作简单、快速、防污染等特点,可实现对产物的定量检测。在利用多重PCR开展检测过程中,引物设计是反应成功的关键[18]。在一个PCR反应体系中,多对引物同时扩增,可能会出现引物间干扰的情况,引物的设计及靶序列的选择不当均可能降低其灵敏度或导致扩增失败,而扩增效率的一致性更是多重PCR技术被广泛运用的一大难题。
本研究的双重荧光定量PCR敏感性试验中,模板为15拷贝·µL−1时,3个重复的Ct值分别为34.25、34.35和33.97,仍有明显的扩增曲线,且重复性较好;接近于陈信忠等[19]建立的单重TaqMan实时荧光定量PCR方法最低检测限(10拷贝·µL−1)和Mendoza-Cano F等[20]建立的SYBR实时荧光定量PCR(12 拷贝·µL−1)。当模板为1.5拷贝·µL−1时,3个重复的Ct值分别为38.86、37.68和未扩增出曲线,重复性较差。因此,为保证检测结果的准确性,在实际检测工作中,以Ct值35.00为临界值,若检测样品的Ct值小于或等于35.00,且有扩增曲线,判为WSSV阳性;Ct值大于35.00,且有扩增曲线,则重复1次,若结果一致,则判为WSSV阳性;Ct值大于35.00,或重复结果未出现扩增曲线,判为WSSV阴性。
本研究通过筛选靶基因、对比目标区域片段、设计特异性引物和探针,建立了WSSV TaqMan探针型荧光定量PCR检测方法。该检测方法对WSSV模板产生特异性单一扩增产物,对非目标模板和阴性对照均未产生扩增,具有较好的重复性,重复性试验中Ct值变异系数均<1.5%。此外,本研究采用引物序列碱基位点替换优化的方法,解决了不同靶基因扩增效率的一致性问题,建立了WSSV−对虾内参基因双重PCR检测方法,对对虾WSSV的检测下限可达15拷贝·µL−1,具有较好的灵敏度。双重荧光定量PCR方法不仅弥补了普通 PCR检测的耗时长、步骤繁琐等不足,解决了样品检测易产生假阳性的问题;同时,还解决了由操作不当、核酸提取不成功而造成的假阴性问题。多重qPCR反应在同一体系下进行,在很大程度上节省了试剂盒材料,达到了检测更加快速、精准,提高检测效率的目的。综上所述,本研究建立的WSSV−对虾内参基因双重qPCR检测体系具有良好的准确性、可靠性和实用性,可作为水产养殖过程中WSSV准确、快速、稳定的检测手段。
-
图 1 pMD18-WSSV重组质粒的荧光定量PCR扩增曲线
注:1为6.6×105拷贝·µL−1;2为6.6×104拷贝·µL−1;3为6.6×103拷贝·µL−1;4为6.6×102拷贝·µL−1;5为6.6×101 拷贝·µL−1;6为6.6拷贝·µL−1。
Figure 1. Amplification plot of qPCR for pMD18-WSSV recombinant plasmid
Notes: 1 means 6.6×105 copies·µL−1; 2 means 6.6×104 copies·µL−1; 3 means 6.6×103 copies·µL−1; 4 means 6.6×102 copies·µL−1; 5, 6 mean 6.6×101, 6.6 copies·µL−1, respectively.
图 5 WSSV−凡纳滨对虾18S rRNA双重荧光定量PCR扩增曲线
注:a表示WSSV qPCR扩增曲线;b表示WSSV-18S rRNA qPCR扩增曲线;c表示WSSV-18S rRNA引物碱基位点替换 qPCR扩增曲线。1~4为WSSV荧光定量PCR扩增曲线;5为对虾18S内参基因引物PCR扩增曲线;6为对虾18S rRNA引物碱基位点替换PCR扩增曲线。
Figure 5. The amplification curve of duplex qPCR for WSSV−18S rRNA of L.vannamei
Notes: a means the amplification curve for WSSV; b means the amplification curve for WSSV-18S rRNA of L.vannamei; c means the amplification curve for WSSV-18S rRNA with primer's base site substitution of L.vannamei. 1−4 mean the amplification curve for WSSV; 5 means the amplification curve for 18S rRNA of L.vannamei; 6 means the amplification curve for WSSV-18S rRNA with primer’s base site substitution of L.vannamei.
图 6 荧光定量PCR的敏感性检测结果
注:1为1.5×105拷贝·µL−1;2为1.5×104拷贝·µL−1;3为1.5×103拷贝·µL−1;4为1.5×102拷贝·µL−1;5为1.5×101拷贝·µL−1;6为1.5拷贝·µL−1;7为0.15拷贝·µL−1;8为凡纳滨对虾18S内参基因引物碱基位点替换PCR扩增曲线。
Figure 6. Sensitivity of qPCR
Notes: 1 means 1.5×105 copies·µL−1; 2 means 1.5×104 copies·µL−1; 3 means 1.5×103 copies·µL−1; 4 means 1.5×102 copies·µL−1; 5 means 1.5×101 copies·µL−1; 6 means 1.5 copies·µL−1; 7 means 0.15 copies·µL−1; 8 means the amplification curve for 18S rRNA with primer’s base site substitution of L. vannamei.
表 1 白斑综合征病毒WSSV荧光定量PCR批内重复性检测
Table 1 Intra-batch variability qPCR test of WSSV
模板量/
(拷贝·µL−1)
Template amount/
(copies·µL−1)Ct均值
Mean Ct标准差
Standard
deviation变异系数/%
Coefficient of
variation6.6×103 22.25 0.21 0.93 6.6×102 25.71 0.38 1.46 6.6×101 29.05 0.32 1.09 表 2 白斑综合征病毒WSSV荧光定量批间重复性检测
Table 2 Inter-batch variability qPCR test of WSSV
模板量/
(拷贝·µL−1)
Template amount/
(copies·µL−1)Ct均值
Mean Ct标准差
Standard
deviation变异系数/%
Coefficient of
variation5.5×102 25.61 0.33 1.31 4.5×102 25.90 0.06 0.24 2.5×101 29.98 0.28 0.95 -
[1] Walker P J, Gudkovs N, Padiyar P A, et al. Longitudinal disease studies in small-holder black tiger shrimp (Penaeus monodon) farms in Andhra Pradesh, India. Ⅰ. High prevalence of WSSV infection and low incidence of disease outbreaks in BMP ponds[J]. Aquaculture, 2011, 318(3 − 4): 277 − 282. DOI: 10.1016/j.aquaculture.2011.05.029
[2] Qiu W, Geng R, Zuo H L, et al. Toll receptor 2 (Toll2) positively regulates antibacterial immunity but promotes white spot syndrome virus (WSSV) infection in shrimp[J]. Developmental & Comparative Immunology, 2021, 115: 103878.
[3] Shekar M, Pradeep B, Karunasagar I. White spot syndrome virus: genotypes, epidemiology and evolutionary studies[J]. Indian Journal of Virology, 2012, 23(2): 175 − 183. DOI: 10.1007/s13337-012-0078-z
[4] 刘训猛,陈静,袁锐,等. 江苏地区养殖中华绒螯蟹白斑综合征病毒(WSSV)流行病学调查[J]. 江苏海洋大学学报(自然科学版),2020,29(1):51 − 55. DOI: 10.3969/j.issn.2096-8248.2020.01.009 Liu X M, Chen J, Yuan R, et al. Epidemiological investigation of white spot syndrome virus (WSSV) on cultured Eriocheir sinensis in Jiangsu area[J]. Journal of Jiangsu Ocean University (Natural Science Edition), 2020, 29(1): 51 − 55. DOI: 10.3969/j.issn.2096-8248.2020.01.009
[5] Chakraborty A, Otta S, Joseph B, et al. Prevalence of white spot syndrome virus in wild crustaceans along the coast of India[J]. Current Science, 2002, 82(11): 1392 − 1397.
[6] 陈红莲,王永杰,张静,等. 安徽省克氏原螯虾白斑综合征病毒检测及疾病分析[J]. 水产养殖,2020,41(2):12 − 16. DOI: 10.3969/j.issn.1004-2091.2020.02.003 Chen H L, Wang Y J, Zhang J, et al. Disease analysis and detection of white spot syndrome virus of Procambarus Clarkii in Anhui[J]. Journal of Aquaculture, 2020, 41(2): 12 − 16. DOI: 10.3969/j.issn.1004-2091.2020.02.003
[7] Desrina, Prayitno S B, Verdegem M C J, et al. White spot syndrome virus host range and impact on transmission[J]. Reviews in Aquaculture, 2022, 14(4): 1843 − 1860. DOI: 10.1111/raq.12676
[8] Lightner D V. A handbook of shrimp pathology and diagnostic procedures for disease of cultured penaeid shrimp[M]. Baton Rouge: World Aquaculture Society, 1996.
[9] Zhu G H, Li S H, Wu J, et al. Identification of functional gene modules associated with STAT-mediated antiviral responses to white spot syndrome virus in shrimp[J]. Frontiers in Physiology, 2019, 10: 212. DOI: 10.3389/fphys.2019.00212
[10] Patil P K, Geetha R, Ravisankar T, et al. Economic loss due to diseases in Indian shrimp farming with special reference to Enterocytozoon hepatopenaei (EHP) and white spot syndrome virus (WSSV)[J]. Aquaculture, 2021, 533: 736231. DOI: 10.1016/j.aquaculture.2020.736231
[11] 吴丽云. 对虾白斑综合征病毒可视化环介导等温扩增(LAMP)快速检测方法的建立[J]. 渔业研究,2019,41(6):478 − 486. Wu L Y. Establishment of rapid detection for shrimp white spot syndrome virus (WSSV) by visual loop-mediated isothermal amplification (LAMP)[J]. Journal of Fisheries Research, 2019, 41(6): 478 − 486.
[12] Saiki R K, Scharf S, Faloona F, et al. Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia[J]. Science, 1985, 230(4732): 1350 − 1354.
[13] Schmittgen T D. Real-time quantitative PCR[J]. Methods, 2001, 25(4): 383 − 385. DOI: 10.1006/meth.2001.1260
[14] Mcdonough E A, Barrozo C P, Russell K L, et al. A multiplex PCR for detection of Mycoplasma pneumoniae, Chlamydophila pneumoniae, Legionella pneumophila, and Bordetella pertussis in clinical specimens[J]. Molecular and Cellular Probes, 2005, 19(5): 314 − 322. DOI: 10.1016/j.mcp.2005.05.002
[15] 蒋彩云,乔琨,许旻,等. 利用RT-qPCR技术筛选菊黄东方鲀的最适内参基因[J]. 渔业研究,2020,42(2):105 − 116. Jiang C Y, Qiao K, Xu M, et al. Selection of appropriate reference genes for real-time quantitative PCR analysis in Takifugu flavidus[J]. Journal of Fisheries Research, 2020, 42(2): 105 − 116.
[16] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. 白斑综合征(WSD)诊断规程 第2部分:套式PCR检测法:GB/T 28630.2—2012[S]. 北京:中国标准出版社,2012. General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China, Standardization Administration of the People’s Republic of China. Diagnostic protocols for white spot disease—part 2: nested PCR method: GB/T 28630.2—2012[S]. Beijing: Standards Press of China, 2012.
[17] 马来,童桂香,韦信贤,等. 基于TaqMan-MGB探针的虾肝肠胞虫荧光定量PCR检测方法[J]. 西南农业学报,2020,33(6):1319 − 1326. Ma L, Tong G X, Wei X X, et al. TaqMan-MGB-based fluorescent quantitative PCR for detection of Enterocytozoon hepatopenaei[J]. Southwest China Journal of Agricultural Sciences, 2020, 33(6): 1319 − 1326.
[18] 官昭瑛,李慧敏,何曼文,等. 多重PCR技术在快速检测中的应用[J]. 山东化工,2021,50(3):85 − 88. DOI: 10.3969/j.issn.1008-021X.2021.03.034 Guan Z Y, Li H M, He M W, et al. Application of multiplex PCR technology in rapid detection[J]. Shandong Chemical Industry, 2021, 50(3): 85 − 88. DOI: 10.3969/j.issn.1008-021X.2021.03.034
[19] 陈信忠,任聪,龚艳清,等. 实时荧光定量PCR法检测对虾白斑综合征病毒[J]. 检验检疫学刊,2009,19(2):7 − 11. DOI: 10.3969/j.issn.1674-5354.2009.02.003 Chen X Z, Ren C, Gong Y Q, et al. Real-time fluorescence quantitative PCR in detecting white spot syndrome virus in penaeid shrimp[J]. Journal of Inspection and Quarantine, 2009, 19(2): 7 − 11. DOI: 10.3969/j.issn.1674-5354.2009.02.003
[20] Mendoza-Cano F, Sánchez-Paz A. Development and validation of a quantitative real-time polymerase chain assay for universal detection of the white spot syndrome virus in marine crustaceans[J]. Virology Journal, 2013, 10(1): 186. DOI: 10.1186/1743-422X-10-186



 下载:
下载: