有机氯(Organochlorines,OCPs)和多氯联苯(Polychlorinated biphenyls,PCBs)是早期工业化过程中用于提高农业和工业生产效率的重要化合物之一,它们的生产和使用促进人们的生活水平得到了显著提高。随着对其了解的加深,人们逐渐发现这些化合物会对生态环境以及人类健康产生一系列危害,如三致效应、生殖毒性以及基因毒性等[1⇓-3]。虽然我国相关政策的出台限制了这类化合物的直接排放,但近年来仍有文献报道水体、沉积物及生物体中OCPs和PCBs的检出[4⇓-6]。OCPs和PCBs作为斯德哥尔摩公约第一批认定的持久性有机污染物(Persistent organic pollutants,POPs),其性质稳定,在生产和使用后会通过雨水冲刷、地表径流和大气沉降等途径进入海洋水体。进入海洋的OCPs和PCBs,部分经过一系列物理化学过程吸附在悬浮颗粒物上,最终沉降进入海底沉积物,部分被生物体吸收、并在体内不断累积和转化,导致生物体内OCPs和PCBs浓度逐渐增加。POPs的污染已经对近岸海洋生态系统中的重要组成,如生物栖息环境、生物多样性以及生物链完整性等,构成了极大的威胁[7⇓-9]。此外,海洋生态系统中的POPs还会通过食物链传递和生物放大效应进一步对一些顶级捕食者的健康产生威胁,如人类和中华白海豚等,他们位于食物链顶端,且拥有较长的生命周期,更易在体内累积有机污染物[10]。
厦门湾位于福建省东南部,是典型的亚热带半封闭性港湾,主要受黑潮、南海暖流、闽浙沿岸水和西侧九龙江口径流的影响[11]。厦门湾为地理位置优越的天然良港,栖息着我国国家一级重点保护海洋珍稀物种——中华白海豚。此外,厦门湾还是我国传统的定置网和流刺网作业海区,海洋生物资源十分丰富,具有重要的社会价值、生态价值和经济价值[12⇓-14]。但是,自20世纪60年代开始,随着工业和农牧业的迅速发展,厦门湾海域环境和生物受到了不同程度的污染。本研究选取不同季节捕获于厦门湾海域不同区域的13种水产动物为研究对象,采用气相色谱质谱联用仪对其体内的OCPs(4种DDTs和4种HCHs)和PCBs(10种)含量进行分析。采用美国环保局(EPA)推荐的接触风险指数(ERI)法和致癌风险指数(CRI)法,评价人类食用受OCPs和PCBs污染水产动物产生的暴露风险;采用Hung C L H等的最大允许摄入量(MACRfD和MACTRV)评价方法,评估中华白海豚捕食受污染水产动物的暴露风险[15]。本研究为探明厦门湾海域不同水产动物中OCPs和PCBs污染特征、揭示水产动物体内的OCPs和PCBs含量的时空变化规律奠定基础,也为沿岸居民海产品食用安全以及厦门湾珍稀物种中华白海豚健康评估提供基础数据。
1 材料与方法
1.1 仪器与试剂
气相色谱-三重四级杆质谱联用仪(GC-MS/MS)(美国赛默飞,TSQ8000evo);旋转蒸发仪(德国IKA,HB eco);氮吹仪(中国安普,24位氮吹仪EFAA-DC24);电子天平(德国sartorius,BAS224S-CW);超纯水仪(中国锐思捷,RODI水纯化系统);微量进样针(瑞士Hamilton,10 μL、100 μL、1 000 μL);马弗炉(中国精宏,SXL-1016T)。
丙酮、正己烷和二氯甲烷(美国西格玛,色谱纯级别4 L);氟罗里硅土柱(美国Supelco,Florisil 6 mL/1 g);无水硫酸钠(中国国药集团,分析纯 500 g);8种OCPs(4种HCHs和4种DDTs)混标(100 mg·L-1)、10种PCBs混标(1 mg·L-1)和内标物氘代菲(100 mg·L-1)均购于国家标准物质中心。
1.2 样品的采集与制备
水产动物样品由自然资源部第三海洋研究所采集并提供。在厦门湾共设置15个站位(图1),为方便后续研究,将15个站位分为3个区域,R1~R4为同安湾海域,R5~R10为厦金海域,R11~R15为九龙江入海口及厦门西港海域。采样时间分别为2019年8月26至29日(夏)、2019年11月25至29日(秋)、2020年2月25至28日(冬)、2020年4月25至29日(春)。样品经鉴定、统计,共计13种,包括条纹叫姑鱼(Johnius fasciatus)、叫姑鱼(Johnius grypotus)、青石斑鱼(Epinephelus awoara)、勒氏短须石首鱼(Sciaena russelli)、褐菖鱼由(Sebastiscus marmoratus)、孔鱼叚虎鱼(Trypauchen vagina)、日本瞳鲬(Inegocia japonica)、中华海鲶鱼(Arius sinensis)、斑鱼祭(Konosirus punctatus)、条纹斑竹鲨(Chiloscyllium plagiosum)、短蛸(Octopus fangsiao)、火枪乌贼(Loligo beka)和曼氏无针乌贼(Sepiella maindroni),共158个样品(表1)。样品经超纯水冲洗后,取肌肉组织,切碎后匀浆,并保存于-20℃下,待处理。
图1
图1
厦门湾水产动物样品采集站位图
Fig.1
Station map of aquatic animal samples collected in Xiamen Bay
表1 厦门湾渔获13种水产动物的样品信息
Tab.1
| 种类 Species | 同安湾 Tong’an Bay | 厦金海域 Xiamen-Jinmen Sea | 九龙江口及厦门西港 The estuary of Jiulong River and Xiamen West Port | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 夏 Summer | 秋 Autumn | 冬 Winter | 春 Spring | 夏 Summer | 秋 Autumn | 冬 Winter | 春 Spring | 夏 Summer | 秋 Autumn | 冬 Winter | 春 Spring | ||||||||||||
| 数量(体长)/(n/cm) Quantity(Body length) | |||||||||||||||||||||||
| 条纹叫姑鱼 Johnius fasciatus | 1 (12) | 2 (9~10) | 2 (13~14) | - | 4 (16~20) | 2 (11~15) | 2 (13~15) | 2 (18) | 3 (8~17) | 3 (10~16) | 4 (10~16) | 3 (10~15) | |||||||||||
| 叫姑鱼 Johnius grypotus | - | 1 (18) | - | 1 (25) | 2 (11~13) | 1 (18) | 1 (13) | 1 (12) | - | - | - | 1 (10) | |||||||||||
| 青石斑鱼 Epinephelus awoara | 3 (12~15) | 2 (10~11) | - | 2 (12~15) | 1 (11) | 2 (16~25) | 3 (12~15) | 2 (11~13) | 1 (8) | 1 (16) | - | 1 (18) | |||||||||||
| 勒氏短须石首鱼 Sciaena russelli | - | 1 (11) | - | - | 2 (12~17) | 1 (20) | 1 (14) | - | - | 1 (10) | 1 (21) | 1 (18) | |||||||||||
| 褐菖鱼由 Sebastiscus marmoratus | - | 2 (12) | 1 (17) | 2 (11~18) | 2 (10~16) | 1 (8) | 4 (12~14) | 4 (9~18) | - | - | - | - | |||||||||||
| 条纹斑竹鲨 Chiloscyllium plagiosum | 1 (40) | - | 2 (25~35) | 2 (30~50) | 1 (41) | - | 4 (23~42) | 2 (21~45) | - | - | 2 (20~46) | 2 (40~50) | |||||||||||
| 孔鱼叚虎鱼 Trypauchen vagina | 1 (16) | 4 (15~20) | - | - | - | 1 (18) | 1 (11) | - | 3 (5~23) | 2 (18~19) | 1 (10) | 2 (15) | |||||||||||
| 日本瞳鲬 Inegocia japonica | 4 (12~15) | - | - | - | 4 (9~20) | 1 (11) | - | - | 1 (20) | - | - | - | |||||||||||
| 斑鱼祭 Konosirus punctatus | - | 1 (20) | 1 (20) | - | - | 1 (25) | 1 (15) | - | - | 1 (16) | 2 (17~19) | 2 (18~20) | |||||||||||
| 中华海鲶 Arius sinensis | - | - | 1 (18) | - | 1 (17) | 4 (16~45) | - | - | 1 (20) | 1 (22) | 2 (18~27) | 2 (24~25) | |||||||||||
| 短蛸 Octopus fangsiao | 2 (12) | - | 1 (18) | - | 2 (16~20) | - | - | - | 2 (12~20) | - | - | - | |||||||||||
| 曼氏无针乌贼 Sepiella maindroni | 1 (12) | - | 1 (30) | - | 3 (6~22) | - | - | - | - | - | - | - | |||||||||||
| 火枪乌贼 Loligo beka | 1 (25) | - | 1 (34) | - | 3 (10~22) | - | 1 (20) | - | - | - | - | - | |||||||||||
注:“-”表示该样品在该季节未获得。
Notes:“-”indicated that the sample was not obtained in this season.
1.3 样品预处理和分析方法
1.3.1 样品预处理
前处理过程中,净化方式参照李荣等的前处理方法[16]。取匀浆后的样品5 g于离心管中,加入过量无水硫酸钠除水后,分别用20 mL和15 mL丙酮和正己烷(1∶1,V∶V)的混合溶剂对样品进行两次萃取,采用超声波辅助萃取,两次超声萃取时间均为15 min。3 500 r·min-1转速离心后,合并上清液于旋转蒸发瓶中,在35℃下用旋转蒸发仪浓缩至2 mL,并转溶为正己烷。浓缩液采用弗罗里硅土柱(Florisil,6 mL/1 g)进行净化,使用之前先后用8 mL二氯甲烷和6 mL正己烷进行活化,并注意勿使净化柱干燥。浓缩液上柱后,再用6 mL正己烷分三次清洗旋转蒸发瓶,转至净化柱。然后采用10 mL丙酮和正己烷(1∶9,V∶V)混合溶剂进行洗脱。收集洗脱液,氮吹浓缩至近干,用正己烷定容至1 mL,于-20℃下保存,待测。
1.3.2 仪器条件
气相色谱质谱联用仪配备色谱柱型号为DB-5ms(30 m×0.25 mm×0.25 μm);进样口温度、离子源温度和传输线温度分别为280、300、300℃;进样量为1 μL;升温程序,初始温度为80℃,保持3 min,然后以20℃·min-1升至180℃并保持5 min,最后以10℃·min-1升至290℃,保持10 min;载气为高纯氦(He,99.999%),载气流速为1.2 mL·min-1。18种目标物的离子信息及质谱参数见附表1。
附表1 18种目标物化合物的离子信息及质谱参数 Appendix.1 Ion information and mass spectrometry parameters of the 18 target compounds
| 目标化合物 Target compound | 保留时间/min Retention time | SRM扫描模式参数 Parameters of SRM scan mode | 线性范围/ (μg/kg) Linear range | 线性系数R2 Linear coefficient | 仪器检测限/ (μg/kg) Instrument detection limit | 方法检出限/ (μg/kg) Method detection limit | ||
|---|---|---|---|---|---|---|---|---|
| 定量离子对/ (m/z) | 定性离子对/ (m/z) | 碰撞能/ eV | ||||||
| α-六六六α-HCH | 12.22 | 180.9~145.0 | 218.9~183.0 | 15/10 | 5~200 | 0.998 1 | 0.12 | 0.02 |
| β-六六六β-HCH | 13.11 | 180.9~145.0 | 218.9~183.0 | 15/10 | 5~200 | 0.999 5 | 0.73 | 0.15 |
| γ-六六六γ-HCH | 13.44 | 180.9~145.0 | 218.9~183.0 | 15/10 | 5~200 | 0.997 4 | 0.20 | 0.04 |
| 氘代菲*Phenanthrene-D10 | 13.97 | 188.2~160.0 | 189.2~161.1 | 20/20 | / | / | / | |
| δ-六六六δ-HCH | 14.42 | 180.9~145.0 | 218.9~183.0 | 15/10 | 5~200 | 0.998 6 | 0.37 | 0.08 |
| PCB28 | 15.46 | 256.0~186.0 | 258.0~186.0 | 25/25 | 5~200 | 0.999 6 | 0.11 | 0.02 |
| PCB52 | 16.47 | 289.9~220.0 | 292.0~220.0 | 25/25 | 5~200 | 0.999 6 | 0.09 | 0.02 |
| PCB155 | 18.45 | 359.9~290.0 | 361.9~289.9 | 30/20 | 5~200 | 0.999 7 | 0.04 | 0.01 |
| PCB101 | 18.72 | 325.9~255.9 | 327.9~256.0 | 25/25 | 5~200 | 0.997 9 | 0.08 | 0.02 |
| PCB112 | 19.00 | 325.9~255.9 | 327.9~256.0 | 25/25 | 5~200 | 0.998 8 | 0.05 | 0.01 |
| p,p'-滴滴伊p,p'-DDE | 19.39 | 246.0~176.1 | 317.9~248.0 | 25/20 | 5~200 | 0.998 1 | 0.04 | 0.01 |
| PCB118 | 20.15 | 325.9~255.9 | 327.9~256.0 | 25/25 | 5~200 | 0.998 3 | 0.08 | 0.02 |
| p,p'-滴滴p,p'-DDD | 20.32 | 235.0~165.0 | 237.0~165.1 | 20/20 | 5~200 | 0.998 3 | 0.04 | 0.01 |
| o,p'-滴滴涕o,p'-DDT | 20.38 | 235.0~165.0 | 237.0~165.1 | 20/25 | 5~200 | 0.998 6 | 0.05 | 0.01 |
| PCB153 | 20.60 | 359.9~289.9 | 361.8~291.9 | 25/25 | 5~200 | 0.999 | 0.05 | 0.01 |
| p,p'-滴滴涕p,p'-DDT | 21.13 | 235.0~165.0 | 237.0~165.1 | 20/20 | 5~200 | 0.998 6 | 0.04 | 0.01 |
| PCB138 | 21.16 | 359.9~289.9 | 361.9~290.0 | 25/25 | 5~200 | 0.999 1 | 0.05 | 0.01 |
| PCB180 | 22.49 | 393.8~323.9 | 395.8~323.9 | 30/30 | 5~200 | 0.999 3 | 0.04 | 0.01 |
| PCB198 | 23.10 | 427.8~357.8 | 429.8~359.9 | 30/30 | 5~200 | 0.998 9 | 0.06 | 0.01 |
注:*表示内标物。
Note:*meant internal standard.
1.3.3 质量控制
采用内标法定量,每批次处理20个样品,包含1个方法空白、1个实验室平行和1个样品加标回收率。OCPs和PCBs的加标回收率分别为82.7%~105.3%、79.4%~99.3%。得出的所有浓度数据均以样品湿重为基础计算。
1.4 风险评价
1.4.1 对人类健康风险评价方法
表2 HCHs、DDTs和PCBs的RfD和CSF值[20]
Tab.2
| 污染物类型 Types of pollutant | 六六六 HCHs | 滴滴涕 DDTs | 多氯联苯 PCBs |
|---|---|---|---|
| 参考剂量/[μg·(kg·d)-1]RfD | 0.80 | 0.50 | 0.02 |
| 致癌斜率系数/[kg·(d·mg)-1]CSF | 1.80 | 0.34 | 2.00 |
一般认为,若CRI≤10-6,则不具备致癌风险;10-6<CRI≤10-5表示存在潜在风险;10-5<CRI≤10-4认为有较大的潜在风险;而CRI>10-4则认为有严重的致癌风险。ERI以1为限值,ERI<1时,为可接受风险,对健康没有影响。
1.4.2 对中华白海豚的健康风险评价方法
本研究采用Hung C L H等的评价方法对中华白海豚有机氯及多氯联苯暴露风险进行评价[15]。该方法基于慢性日参考剂量RfD(Reference dose,mg·kg-1 wet weight d-1)和毒性参考值TRV(Toxicity reference value,mg·kg-1 wet weight d-1)进行剂量反应评价,通常参考剂量RfD是与人类健康相关的参数,而TRV是与哺乳动物健康相关的参数。最大允许浓度MAC(Maximum allowable concentration),代表水产动物体内不会对中华白海豚造成不利影响的污染物浓度。基于RfD的MACRfD计算公式由化学物质摄入量推导得出。化学物质摄入量Intake(mg·kg-1 d-1)公式如下:
式中,CF(Concentration in fish)代表水产动物肌肉内污染物的浓度(mg·kg-1 wet weight);EF(Exposure frequency)代表暴露频率(d·year-1);ED(Exposure duration)代表暴露周期(year);BW(Body weight)代表体质量(kg);AT(Average time)代表平均时间(每天平均暴露时间);IR(Ingestion rate)代表摄入率;FI(Fraction ingested)代表摄入分数,风险评估所用参数详情见表3。
表3 中华白海豚风险评估相关参数
Tab.3
| 参数Parameters | 值Value |
|---|---|
| 水产动物肌肉组织中 污染物浓度CF | 平均值或第95、50和5百分位数浓度 |
| 摄入率IR | 9 kg·d-1(大约体重的5%) |
| 摄入分数FI | 0.9a |
| 暴露频率EF | 365 d·year-1 |
| 暴露周期ED | 35 years(假定其寿命为暴露时间) |
| 体质量BW | 185 kg |
| 平均暴露时间AT | 12 775 d(35×365 d) |
注:“a”表示数据来源于搁浅的中华白海豚胃溶物分析[
Notes:“a” indicated that the data were from the analysis of gastric solutes of stranded Sousa chinensis[
当Intake=RfD或TRV,而且CF=MACRfD或MACTRV时:
风险商RQ由以下公式计算:
在本研究中,将暴露评估和剂量反应评估得出的结果综合起来对中华白海豚进行风险评估;RQ≤1表示对中华白海豚没有影响,RQ>1则表示对中华白海豚的健康存在影响。
1.5 数据分析
采用统计分析软件IBM-SPSS statistics 22对不同水产动物体内有机污染物的差异进行单因素方差分析(One-way ANOVA),并采用Tukey’s检验差异的显著性。
2 结果与分析
2.1 13种水产动物OCPs及PCBs残留特征
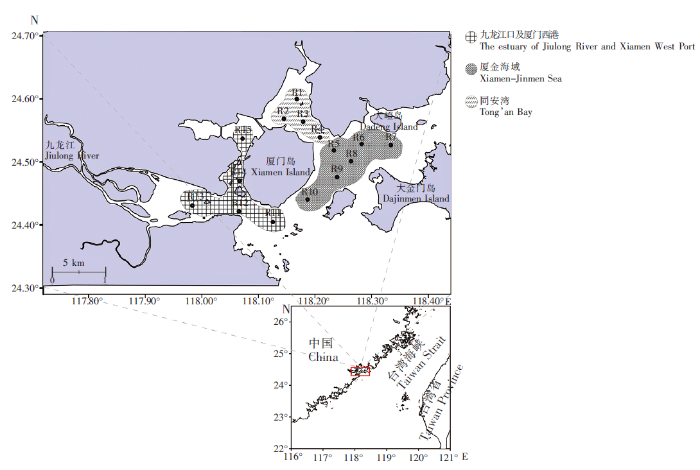
厦门湾海域13种水产动物肌肉中HCHs、DDTs和PCBs残留量见图2。由图2可知,13种水产动物均受到HCHs、DDTs和PCBs不同程度的污染,其中,中华海鲶和斑鱼祭肌肉组织中有机污染物总量相对较高,检出浓度范围分别为0.98~75.77 μg·kg-1和1.73~26.89 μg·kg-1,平均检出浓度分别为12.61、11.41 μg·kg-1;同属石首鱼科的水产动物如条纹叫姑鱼、叫姑鱼、勒氏短须石首鱼,平均检出浓度均在5.00~10.00 μg·kg-1范围内,而青石斑鱼肌肉中的平均检出浓度则相对较小,为2.70 μg·kg-1;褐菖鱼由、日本瞳鲬、条纹斑竹鲨以及孔鱼叚虎鱼肌肉中平均检出浓度均在5.00 μg·kg-1以下,分别为3.12、2.46、2.02、1.32 μg·kg-1;头足类有机污染物残留水平整体较低,其中只有火枪乌贼平均检出浓度(5.10 μg·kg-1)较高,而短蛸和曼氏无针乌贼平均检出浓度则分别为1.15、0.82 μg·kg-1。
图2
图2
13 种水产动物肌肉组织中六六六、滴滴涕及多氯联苯污染物残留水平
Fig.2
Residual levels of ΣHCH,ΣDDT and ΣPCB of muscle tissue in 13 aquatic animals
本次研究的有机污染物中,HCHs检出频率最低,其在13种水产动物肌肉中检出频率范围为0%~56%,检出浓度范围为ND~1.12 μg·kg-1。HCHs在斑鱼祭肌肉中检出率最高,为56%(n=9),检出浓度范围在ND~0.16 μg·kg-1之间,平均检出浓度为0.05 μg·kg-1;最高检出浓度出现在日本瞳鲬肌肉中,为1.12 μg·kg-1,但在日本瞳鲬中HCHs的检出率仅为10%(n=10);3种头足类水产动物肌肉内,HCHs的检出频率为0%。差异性分析结果显示,不同水产动物间HCHs肌肉组织残留量无显著性差异(P<0.05)。DDTs的检出浓度范围为0.10~74.94 μg·kg-1,在3种有机污染物中,检出量占比最高。DDTs在所有种类的水产动物肌肉中均有检出,最大浓度发现于中华海鲶体内,为74.94 μg·kg-1。按DDTs残留的平均浓度从大到小排列,13种水产动物依次为中华海鲶、斑鱼祭、条纹叫姑鱼、叫姑鱼、勒氏短须石首鱼、火枪乌贼、褐菖鱼由、青石斑鱼、日本瞳鲬、条纹斑竹鲨、孔鱼叚虎鱼、短蛸和曼氏无针乌贼,其中中华海鲶与斑鱼祭肌肉内残留的DDTs要显著高于青石斑鱼、褐菖鱼由、条纹斑竹鲨、孔鱼叚虎鱼、日本瞳鲬、短蛸和曼氏无针乌贼(P<0.05)。PCBs在13种水产动物中检出浓度范围为ND~0.72 μg·kg-1,同样在中华海鲶和斑鱼祭体内发现了较高的残留水平。各水产动物肌肉内PCBs平均检出浓度按从大到小排序,依次为中华海鲶、斑鱼祭、叫姑鱼、勒氏短须石首鱼、条纹叫姑鱼、火枪乌贼、日本瞳鲬、褐菖鱼由、短蛸、条纹斑竹鲨、曼氏无针乌贼、孔鱼叚虎鱼和青石斑鱼,其中中华海鲶体内的PCBs残留量(0.12 μg·kg-1)显著高于青石斑鱼、条纹斑竹鲨、孔鱼叚虎鱼以及曼氏无针乌贼(P<0.05)。中华海鲶在春季,会由深水向河口生殖洄游,九龙江口是其产卵场,斑鱼祭也具有洄游特性,喜栖息于河口区域,而其余水生动物则没有明显的河口生活习性[22⇓-24]。而且根据相关研究结果,九龙江入海口及厦门西港海域沉积环境中OCPs与PCBs的残留量要高于同安湾及厦金海域[25]。因此,具有河口生活习性的水产动物可能有较大概率在体内蓄积这些污染物。
2.2 水产动物有机氯及多氯联苯污染的时空特征
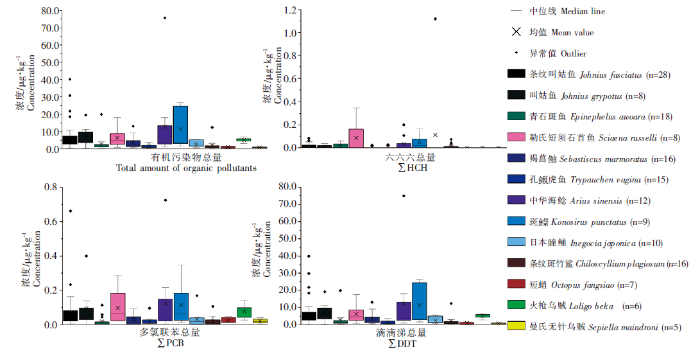
厦门湾海域水产动物污染物水平的时空分布特征见图3,相较于同安湾和厦金海域,九龙江口与厦门西港海域水产动物的有机污染较严重,其体内有机污染物总量的平均值仅在秋季时较低,为2.15 μg·kg-1,其余季节均高于同安湾和厦金海域;在秋季、冬季和春季,同安湾与厦金海域有机污染物的检出水平基本持平,均在4.00 μg·kg-1左右,而在夏季,厦金海域平均检出浓度要高于同安湾海域。
图3
图3
厦门湾13 中水产动物体内有机污染物时空特征
Fig.3
Temporal and spatial characteristics of organic pollutants in 13 aquatic animals in Xiamen Bay
在同安湾和厦金海域,水产动物体内有机污染物的检出水平随季节性变化不明显,但在九龙江口及厦门西港海域有机污染物的检出则呈现出一定的季节性变化。HCHs在九龙江口与厦门西港海域的检出频率存在一定的季节性变化,夏季时所有样品均未检出(n=11),在秋季和冬季时的检出频率有所提升,分别为33%(n=9)、42%(n=12),而在春季时样品中HCHs的检出频率达到最高,为86%(n=14)。DDTs和PCBs在九龙江口与厦门西港海域所有样品中的平均检出浓度也呈现出明显的季节性变化。DDTs的平均检出浓度在冬季和春季时检出浓度较高,分别为12.96、7.41 μg·kg-1,在夏季和秋季时检出浓度则较低,分别为5.80、2.11 μg·kg-1;PCBs的检出特征与DDTs相似,夏、秋两季平均检出浓度较低,均为0.02 μg·kg-1,而在冬、春两季平均检出浓度则相对较高,分别为0.14、0.08 μg·kg-1。
2.3 水产动物中有机氯及多氯联苯来源分析
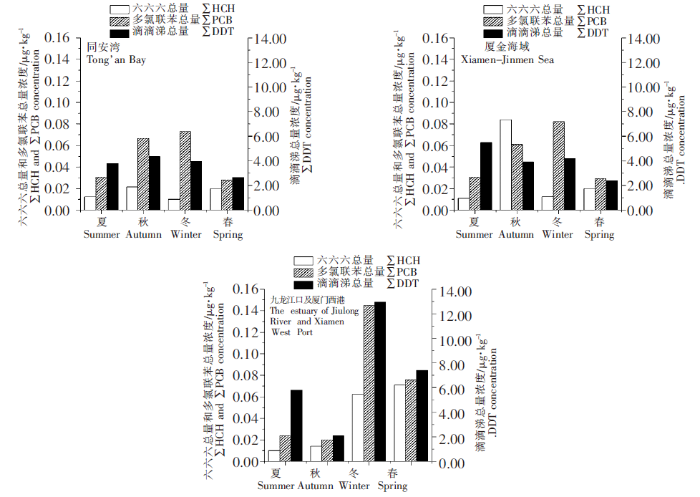
所考察的HCHs四种单体[α-HCH(ND~0.28 μg·kg-1)、β-HCH(ND~0.15 μg·kg-1)、γ-HCH(ND~0.34 μg·kg-1)和δ-HCH(ND~0.50 μg·kg-1)]在13种水产动物肌肉中均有检出,检出频率分别为15.82%、1.27%、1.90%和5.70%,从检出频率上看,α-HCH>δ-HCH>γ-HCH>β-HCH。环境样品中HCHs残留输入状况通常以α/γ比值进行分析,在本研究中,由于同时检出α-HCH和γ-HCH的样品只有一个,因此本研究未对HCHs进行来源分析。
DDTs在不同的自然环境中可降解为不同的产物,若无新DDT输入,DDT的相对含量会不断降低,相应产物的含量就会不断升高;DDT在有氧条件下转化为p,p’-DDE,而在厌氧条件下降解为p,p’- DDD,因此可通过DDT/(DDD+DDE)和DDD/DDE的比值,来示踪DDT的降解环境和降解程度,判断是否有新的DDT农药输入[26-27]。本研究中,p,p’-DDE检出频率为100%,占DDTs检出总量的主要部分,平均检出浓度为2.40 μg·kg-1;其次是p,p’-DDD和p,p’-DDT,平均检出浓度分别为1.36、1.21 μg·kg-1;而o,p’-DDT则在所有水产动物中均未检出。林姗姗[28]、陈茜茜[29]、周博[30]对九龙江流域水体中的有机污染物进行了监测,结果发现DDTs在2012—2018年间基本未检出,仅2014年间有零星检出。在本研究中,所有样品中DDT/(DDD+DDE)值均小于1(图3),这些均表明厦门湾海域已无DDTs输入。此外,从图4可以看出样品中有86.1%的p,p’-DDE/p,p’- DDD值大于1,这意味着DDTs的环境和生物降解过程主要以有氧条件下的降解为主。
图4
图4
厦门湾海域13 种水产动物肌肉内DDT/(DDD+DDE)、p,p’-DDE/p,p’-DDD 值和PCBs 各组分占比
Fig.4
The value of DDT/(DDD+DDE)and p,p’-DDE/p,p’- DDD and the proportion of various PCBs in 13 aquatic animals in Xiamen Bay
我国生产的PCBs工业产品主要为3Cl CBs和5Cl CBs,高氯代单体(>6Cl)的含量很少,而高氯代PCBs主要来源于燃烧过程带来的人为污染,如水泥的高温煅烧、废弃物燃烧等与热相关的过程[31]。因此低氯代PCBs可以用来指示工业商品污染,而高氯代PCBs可以用来指示现代人为污染。在本研究中,厦门湾13种水产动物肌肉中三氯联苯(PCB28)、四氯联苯(PCB52)、五氯联苯(PCB138、PCB153和PCB155)、七氯联苯(PCB180)和八氯联苯(PCB198)检出率及平均检出比重在同安湾、厦金海域和九龙江口及厦门西港海域三个区域均较低,而六氯联苯(PCB138、PCB153和PCB155)在三个区域的平均检出比重均占主导地位,分别为96.6%、89.7%和88.2%(图4)。
2.4 风险评价
2.4.1 人类健康风险评价结果
采用USEPA健康风险评价模型对水产样品中的HCHs、DDTs和PCBs进行风险评估,并采用第5、50和95百分位对数据进行统计,详情见表4。结果表明HCHs和PCBs的接触风险指数ERI均远小于1;而DDTs仅ERI(95th)大于1,ERI(50th)和ERI(5th)均小于1。HCHs、DDTs和PCBs的致癌风险指数CRI结果则显示,同安湾和厦金海域CRI(HCHs)均在1×10-6~1×10-5范围内,而在九龙江口及厦门西港海域,CRI(HCHs)仅在第95百分位时大于1×10-5;三个区域在第5和50百分位时CRI(PCBs)均小于1×10-5;最值得注意的是DDTs的污染,它的CRI(DDTs)均大于1×10-6,尤其是同安湾和九龙江口及厦门西港的样品的CRI(DDTs)均大于1×10-5。
表4 水产动物肌肉中OCPs与PCBs接触风险指数ERI与致癌风险指数CRI
Tab.4
| 采样区域 Sampling area | 化合物名称 Compound name | 接触风险指数ERI Exposure risk index | 致癌风险指数CRI Cancer risk index | ||||
|---|---|---|---|---|---|---|---|
| 5th | 50th | 95th | 5th | 50th | 95th | ||
| 同安湾 Tong’an Bay | HCHs | <0.01 | <0.01 | <1 | 1.40×10-6 | 1.40×10-6 | 6.77×10-6 |
| DDTs | <0.1 | <1 | 2.16 | 1.01×10-5 | 5.13×10-5 | 4.74×10-4 | |
| PCBs | <0.01 | <0.1 | <1 | 6.20×10-7 | 3.10×10-6 | 2.17×10-5 | |
| 厦金海域 Xiamen-Jinmen Sea | HCHs | <0.01 | <0.1 | <1 | 1.40×10-6 | 1.40×10-6 | 9.00×10-6 |
| DDTs | <0.1 | <0.1 | 2.29 | 7.08×10-6 | 5.64×10-5 | 5.03×10-4 | |
| PCBs | <0.01 | <0.1 | <1 | 6.20×10-7 | 3.10×10-6 | 2.99×10-5 | |
| 九龙江口及厦门西港 The estuary of Jiulong River and Xiamen West Port | HCHs | <0.01 | <0.1 | <1 | 1.40×10-6 | 1.40×10-6 | 3.70×10-5 |
| DDTs | <0.1 | <1 | 3.05 | 1.36×10-5 | 7.71×10-5 | 6.71×10-4 | |
| PCBs | <0.01 | <0.1 | <1 | 6.20×10-7 | 4.65×10-6 | 4.19×10-5 | |
2.4.2 中华白海豚健康风险评价结果
本研究采用第5、50和95百分位对中华白海豚通过进食暴露PCB和OCP风险的相关数据进行统计,表5总结了分别基于MACRfD和MACTRV计算得出的RQ(5th、50th、95th)。可以看出,RQ(MACTRV)均小于1,而RQ(MACRfD)仅在第95百分位大于1。
表5 基于MACRfD和MACTRV计算得出的有机污染物的风险商
Tab.5
| 采样区域 Sampling area | 化合物名称 Compound name | 基于RfD Base on reference dose | 基于TRV Base on toxicity reference value | ||||
|---|---|---|---|---|---|---|---|
| RQ (5th) | RQ (50th) | RQ (95th) | RQ (5th) | RQ (50th) | RQ (95th) | ||
| 同安湾海域 Tong’an Bay | HCHs | <0.01 | <0.01 | <0.01 | <0.001 | <0.001 | <0.001 |
| DDTs | <0.1 | <1 | 1.58 | <0.001 | 0.002 | 0.021 | |
| PCBs | <0.01 | <0.1 | <1 | <0.001 | <0.001 | 0.006 | |
| 厦金海域 Xiamen-Jinmen Sea | HCHs | <0.01 | <0.01 | <0.01 | <0.001 | <0.001 | <0.001 |
| DDTs | <0.1 | <1 | 1.67 | <0.001 | 0.002 | 0.022 | |
| PCBs | <0.01 | <0.1 | <1 | <0.001 | <0.001 | 0.008 | |
| 九龙江口及厦门西港 The estuary of Jiulong River and Xiamen West Port | HCHs | <0.01 | <0.01 | <0.1 | <0.001 | <0.001 | <0.001 |
| DDTs | <0.1 | <1 | 2.23 | <0.001 | 0.003 | 0.029 | |
| PCBs | <0.01 | <0.1 | <1 | <0.001 | <0.001 | 0.012 | |
3 讨论
水生生物体内污染物的浓度往往与其栖息水环境污染状况密切相关[33]。在九龙江口及厦门西港海域,水环境主要受九龙江径流的影响,然而相关研究显示九龙江径流对厦门湾海域已无OCPs输入,因此该海域水体中HCHs和DDTs浓度水平会受径流输入的稀释和沉积物的再释放两者共同影响。在8月和11月,九龙江流域处于丰水期-平水期过程,上游未受污染的水源大量流入九龙江口及厦门西港,此时上游洁净水源的稀释作用可能占主导,造成水体浓度降低,进而导致生物体内污染物浓度降低;而在2月和4月,九龙江流域处于枯水期-平水期过程,径流流量变小,此时沉积物再释放可能占主导,造成水体浓度升高,进而导致生物体内污染物浓度升高。遗憾的是,本研究未同时对该海域水体和沉积物中HCHs、DDTs和PCBs的浓度水平进行调查,因此后续将加强相关研究,进一步探讨九龙江口及厦门西港水产动物体内污染物季节性变化的原因。
厦门湾海域已无DDTs的输入在本研究中得到了进一步确证,因此生物体内DDTs污染主要来源于沉积物的再释放。PCBs来源分析则表明厦门湾海域PCBs的污染并非来源于工业产品的污染,而是来源于煅烧、燃烧等与热相关的现代人为污染。虽然厦门湾水产动物HCHs、DDTs和PCBs的污染几乎不会对人类造成接触风险,但DDTs的污染却会对人类造成潜在的致癌风险,并且有一定概率造成较大的甚至严重的致癌风险。本研究仅考察了水产动物肌肉组织中的污染物含量,然而相关研究表明,鱼内脏中污染物浓度往往比肌肉组织高,如张小辉等[34]发现汉江黄颡鱼内脏中DDTs的平均含量为123.3 μg·kg-1,大约是肌肉组织内的5倍(24.27 μg·kg-1)。中华白海豚进食方式为整鱼吞噬,因此利用肌肉组织中的污染物浓度对中华白海豚进行风险评价可能会导致结果偏低。
4 结论
本文对厦门湾海域常见的13种水生动物中8种OCPs和10种PCBs含量进行了分析研究,探讨了其污染特征,对其来源进行分析,并对人类以及中华白海豚食用安全风险进行了评估,得出以下结论:
1)HCHs、DDTs已禁用多年,但在此次调查中发现水产动物肌肉组织中仍有一定浓度的HCHs和DDTs残留。历史遗留的OCPs污染问题仍然对厦门湾海域的生态环境、人类和中华白海豚等顶级捕食者的健康产生着持续的影响。
2)与HCHs和PCBs相比,DDTs在厦门湾13种水生动物肌肉组织内平均含量较高;中华海鲶和斑鱼祭体内有机污染物平均含量会高于其他水生动物;相对于同安湾和厦金海域,九龙江口与厦门西港海域水产动物受到的有机污染较严重;九龙江口及厦门西港海域有机污染物的检出呈现出冬季和春季平均检出浓度和检出频率高于夏季和秋季。这些特征对人类食用水产品的种类和季节等具有一定的指导性意义。
3)来源分析结果显示,厦门湾水产动物体内的DDTs污染主要来源于历史残留;PCBs的污染主要是来源于煅烧、燃烧等与热相关的人类行为过程,如水泥的煅烧。风险评价结果显示,厦门湾水产动物体内HCHs和PCBs的污染基本不会对人类产生风险,而DDTs的污染则会对人类造成潜在的致癌风险,有一定概率造成较大的甚至严重的致癌风险;由于中华白海豚进食方式为整鱼吞噬,因此针对中华白海豚的评价结果可能偏低。
参考文献
In vitro assessment of environmental stress of persistent organic pollutants on the Indo-Pacific humpback dolphin
[J].
联苯菊酯对菲律宾蛤仔肝胰腺细胞DNA损伤的初探
[J].为了评价联苯菊酯的遗传毒性,研究了不同浓度联苯菊酯对菲律宾蛤仔肝胰腺细胞DNA的损伤作用。研究分别在0.05、0.10、0.15、0.20 mg/L联苯菊酯暴露25 d后,取菲律宾蛤仔肝胰腺细胞并用单细胞凝胶电泳(彗星实验)进行分析,以彗尾DNA相对含量(TDNA%)、彗星尾长(TL)、Olive尾矩(OTM)和拖尾率(TR)作为DNA损伤的指标,实验结果表明:与空白对照组相比,各处理组菲律宾蛤仔肝胰腺细胞DNA均有不同程度的损伤且各检测指标值均显著增加(P<0.05);随着联苯菊酯浓度的增加,各检测指标均呈规律性的增长趋势,具有高度的相关性(r>0.99),表现出良好的剂量效应关系。评价彗星实验较好的检测指标为彗尾DNA相对含量和Olive矩,实验获得的多元回归方程具有显著的统计学意义(P<0.01),可以有效地推断联苯菊酯对菲律宾蛤仔的染毒毒性浓度。
海洋主要污染物对贝类及其环境的影响
[J].为给海水贝类健康养殖提供依据,本文总结了近年国内外的报道,从氮、磷、重金属、石油类、有机氯农药等海洋污染物对贝类及其环境影响及进行了归纳综述,发现由于特殊的取食方式,贝类体内的污染物含量较其它生物要高,此外,同种污染物在不同种类贝类体内的积累也存在显著差异。因此,贝类养殖区的选择要比其他养殖区的选择更加谨慎,另外,也可以针对不同养殖海域的具体情况因地制宜的选择不同的养殖种类。
Polyfluoroalkyl compounds in the aquatic environment:A review of their occurrence and fate
[J].The occurrence and fate of polyfluoroalkyl compounds (PFCs) in the aquatic environment has been recognized as one of the emerging issues in environmental chemistry. PFCs comprise a diverse group of chemicals that are widely used as processing additives during fluoropolymer production and as surfactants in consumer applications for over 50 years. PFCs are known to be persistent, bioaccumulative and have possible adverse effects on humans and wildlife. As a result, perfluorooctane sulfonate (PFOS) has been added to the persistent organic pollutants (POPs) list of the Stockholm Convention in May 2009. However, their homologues, neutral precursor compounds and new PFCs classes continue to be produced. In general, several PFCs from different classes have been detected ubiquitously in the aqueous environment while the concentrations usually range between pg and ng per litre for individual compounds. Sources of PFCs into the aqueous environment are both point sources (e.g., wastewater treatment plant effluents) and nonpoint sources (e.g., surface runoff). The detected congener composition in environmental samples depends on their physicochemical characteristics and may provide information to their sources and transport pathways. However, the dominant transport pathways of individual PFCs to remote regions have not been conclusively characterised to date. The objective of this article is to give an overview on existing knowledge of the occurrence, fate and processes of PFCs in the aquatic environment. Finally, this article identifies knowledge gaps, presents conclusions and recommendations for future work.
Bioaccumulation of organic pollutants in Indo-Pacific humpback dolphin:A review on current knowledge and future prospects
[J].
厦门西部海域春季游泳动物资源的调查研究
[J].根据2015年3月厦门西部海域游泳动物资源调查资料,对该海域的游泳动物组成特征进行了初步探讨。结果显示,共捕获游泳动物98种,其中鱼类51种、虾类16种、蟹类23种、口足类5种、头足类3种。优势种类有日本蟳(Charybdis japonica)、脊尾白虾(Exopalaemon carinicauda)、凤鲚(Coilia mystus)、叫姑鱼(Johnius belengerii)和哈氏仿对虾(Parapenaeopsis hardwickii)等5种。各站位游泳动物Margalef丰富度指数(D)平均为5.358,Shannon-Wiener多样性指数(H')平均为2.365,Pielou均匀度指数(J')平均0.732,平均资源量为307.068 kg∕km2。鱼类、虾类、蟹类、口足类、头足类的资源量分别为192.7、28.8、72.7、7.9、5.0 kg/km2。与历史资料比较,游泳动物的种类和资源量均明显下降,亟需加强渔业资源的管理与保护。
A preliminary risk assessment of organochlorines accumulated in fish to the Indo-Pacific humpback dolphin(Sousa chinensis)in the Northwestern waters of Hong Kong
[J].The Indo-Pacific humpback dolphin is considered threatened due to several factors including pollution in Hong Kong and the risks due to consumption of fish tainted with polychlorinated biphenyls (PCBs) and organochlorine pesticides were assessed. Six species of fish Collichthys lucida, Pseudosciaena crocea, Johnius sp., Thryssa sp., Mugil sp. and Trichiurus sp., which comprise the main prey species of humpback dolphins were collected for analyses. Risks due to total PCBs, total TEQs, PCB 118 and the pesticides were assessed with the use of toxicity reference values as the threshold reference benchmarks. The calculated risk quotients (RQs) showed that the risks associated with organochlorines were generally low. The highest RQ was associated with total TEQs suggesting that dioxin-like PCBs may pose the highest risk to the dolphins. The HCHs, total PCBs and heptachlor had comparatively high RQs and thus they should also be the priority organochlorines that would require further investigation.
Population biology of the Indo-Pacific hump-backed dolphin in Hong Kong waters
[J].
Fish Behavior 1:Eco‐ethology
[M].
Fish Behavior 2:Ethophysiology
[M].
Unusual persistence of DDT in some Western USA soils
[J].