在我国石珊瑚主要分布在南海、东海海域,浅水石珊瑚分布在海南、广西、广东、台湾和福建沿海地区[7⇓⇓-10]。福建沿海浅水石珊瑚目前共计记录17种,隶属6科14属,其中造礁石珊瑚3科8属9种,非造礁石珊瑚3科6属8种,是我国石珊瑚分布北界[11-12]。厦门海域历史调查记录石珊瑚2科4属5种,分别为标准蜂巢珊瑚(Dipsastraea speciosa)、粗糙菊花珊瑚(Coelastrea aspera)、华丽筒星珊瑚(Tubastrea ayrea)、肯氏锥形珊瑚(Balanophyllia cumingii)和猩红筒星珊瑚(Tubastrea coccinea)[13⇓⇓-16]。猩红筒星珊瑚隶属石珊瑚目(Seleractinia)、木珊瑚科(Dendrophyllidae)、筒星珊瑚属(Tubastraea),多数学者将其列为非造礁石珊瑚[11,17⇓-19]。其活体呈深红色或橙色,触手橙色或黄色,松软且有弹性,伸展良好,骨骼呈杯椭圆形,有4轮隔片,成六边形排列。猩红筒星珊瑚分布较广,在海南、广东、广西、台湾和福建海域均有分布,在福建主要分布于台山列岛、牛山岛、厦门湾、东山等海域,是福建有记录的石珊瑚种类中属于分布最广的种类,这说明其适应海域自然环境条件较强,因此本研究选取猩红筒星珊瑚作为移植对象。
目前,在福建海域开展人工移植石珊瑚研究尚未见报道。本研究选取厦门同安湾海域开展人工移植石珊瑚试验,旨在了解石珊瑚在移植地野外生长的生物学特征,揭示影响其存活和生长的主要因子,探讨在该海区移植珊瑚的可行性,为进一步开展珊瑚移植、拓展海底旅游景观资源提供参考。
1 材料与方法
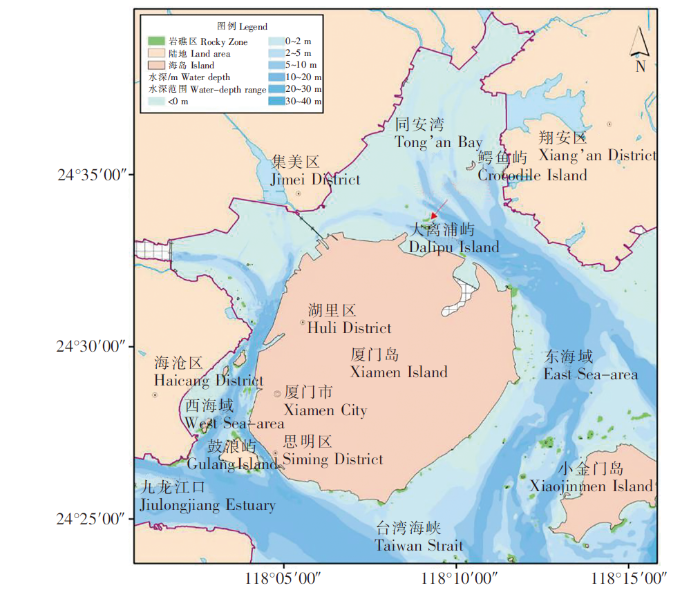
1.1 试验区海洋自然概况
表1 厦门同安湾海域海水水温、盐度、透明度测量值
Tab.1
| 时间/月份 Time/month | 表层水温/℃ Surface-layer water-temperature | 底层水温/℃ Bottom-layer water-temperature | 表层盐度 Surface-layer salinity | 底层盐度 Bottom-layer salinity | 海水透明度范围/m Seawater clarity range |
|---|---|---|---|---|---|
| 2月 February | 15.73 | 15.64 | 28.75 | 28.90 | 2.2~3.5 |
| 5月 May | 22.52 | 22.10 | 26.31 | 26.68 | 1.8~3.2 |
| 9月 September | 27.79 | 27.72 | 29.78 | 30.23 | 1.1~1.7 |
| 11月 November | 20.44 | 22.29 | 28.74 | 30.07 | 1.2~1.3 |
图1
1.2 样品的采集与运输
本研究选取在我国分布较广的猩红筒星珊瑚作为移植对象,样品采自福鼎台山列岛海域。台山列岛位于福鼎以东30 km的东海大陆架海域,由东台山、西台山、南船屿等15个岛屿及22个礁石组成,周边海域受黑潮分支——台湾暖流和浙闽沿岸流的共同影响,记录为中国大陆沿海造礁石珊瑚自然分布的北缘,周围水深0~30 m,海底多岩礁,水质清澈,透明度为0.3~2.4 m,底层海水水温13.5~25.0℃,底层海水盐度30.5~33.9℃。[11]
2012年10月,在台山列岛周边海底岩礁区潜水挑选生长状况较好的珊瑚,连同其附着的块石一同采集,暂养在浅海区。运输当天将其移至注满海水的样品箱内,并进行人工增氧,采用水族缸暂养模式运往厦门,并于当天内放置于试验海域,全程运输时间在12 h之内。
1.3 样品的移植与观测
综合考虑栖息地的自然环境、水深、人类活动影响、试验测量条件等因素,本研究选取同安湾作为移植试验区。但同安湾海域沉积类型主要为砂、粉砂、黏土,基岩出露甚少,仅在鳄鱼屿、大离浦屿周边海域潮间带浅海有少量岩礁分布,而该区域由于水深较浅,捕捞、养殖等人类活动较多,不利于开展海底试验工作。因此,利用七二五所大离浦海上试验平台开展珊瑚移植试验。该海域底质类型为泥质砂,水深8~10 m。试验时将珊瑚放置在样品框内,并将样品框悬挂在试验平台上,设置4个悬挂位置11个悬挂点,下沉至水深5 m处,与样品采集区水深基本相同。
2012年11月至2014年2月期间,每月对移植点周边的海水温度、盐度、浊度、透明度进行测量;提取样品框观测移植珊瑚的生长情况,对珊瑚的形态、颜色、高度等生物学参数进行测量、记录和拍照,并及时将样品框悬挂回原位置。
温度、盐度、浊度测量方法:采用加拿大RBR公司的XR-620 CTD+Tu型温盐深浊度剖面仪(采样率6 Hz),自动测量温度、盐度、深度和浊度;海水透明度根据《海洋监测规范》(GB/T 12763.6—2007)利用透明度盘测定;高度:拍照记录每次测量位置,用游标卡尺测量最高和最宽的位置,作为高度和宽度。
2 结果
2.1 海洋环境观测结果
2012年11月至2014年2月期间,移植点海域主要生态环境影响因子的观测结果显示(表2):平均水温21.71℃,最高值30.11℃出现在2013年8月,最低值15.27℃出现在2013年2月;海水平均盐度28.17,最高值30.35出现在2013年11月,最低值21.98出现在2013年7月;海水平均浊度17.43 FTU,最高值50.31 FTU出现在2013年3月,最低值2.91 FTU出现在2013年2月。海水底层温度、盐度、浊度变化趋势:温度冬季低、春季逐渐升高,至夏季最高,秋季逐渐降低;盐度变化趋势是春末夏初较低,即6月至8月为一年中较低时段,其余基本变化不大;浊度变化多次波动,变化范围比较大(图2)。
表2 海水温度盐度浊度观测统计表
Tab.2
| 观测时间 Observing time | 表层温度/℃ Surface-layer temperature | 底层温度/℃ Bottom-layer temperature | 表层盐度 Surface-layer salinity | 底层盐度 Bottom-layer salinity | 表层浊度/FTU Surface-layer turbidity | 底层浊度/FTU Bottom-layer turbidity |
|---|---|---|---|---|---|---|
| 2012-12-11 | 17.43 | 17.45 | 28.55 | 28.89 | 14.52 | 28.50 |
| 2013-01-25 | 15.36 | 15.39 | 28.02 | 28.13 | 14.83 | 14.99 |
| 2013-02-22 | 15.45 | 15.27 | 28.66 | 29.22 | 4.04 | 2.91 |
| 2013-03-26 | 19.05 | 19.01 | 28.07 | 28.21 | 50.31 | 46.74 |
| 2013-04-23 | 19.71 | 19.38 | 28.60 | 29.39 | 3.68 | 4.70 |
| 2013-05-24 | 24.92 | 24.71 | 27.21 | 27.66 | 9.43 | 16.58 |
| 2013-06-24 | 29.08 | 28.85 | 27.48 | 28.21 | 12.42 | 34.53 |
| 2013-07-20 | 29.19 | 28.98 | 21.98 | 22.75 | 7.61 | 12.27 |
| 2013-08-21 | 30.10 | 30.11 | 28.65 | 28.66 | 21.72 | 25.34 |
| 2013-09-28 | 27.18 | 26.81 | 27.15 | 29.79 | 9.76 | 16.95 |
| 2013-11-21 | 20.57 | 20.41 | 30.21 | 30.35 | 16.56 | 21.13 |
| 2014-02-20 | 13.38 | 13.34 | 30.17 | 30.16 | 9.52 | 19.40 |
图2
图2
珊瑚移植试验期间底层海水温度、盐度、浊度
Fig.2
The temperature, salinity and turbidity of bottom sea water during the experiment of Tubastraea coccinea transplantation
2.2 移植珊瑚的存活状况
2012年10月,移植当天,采集的11个珊瑚样本均存活,呈深红色或橙色,触手橙色或黄色,松软且有弹性,伸展良好(图3 a、b、c、d)。2012年11月至2013年4月期间,珊瑚均存活,触手伸展良好,颜色和形态未出现明显变化。2013年5月,同安湾及周边陆域普降暴雨,入海量径流增大,海水盐度骤降,部分珊瑚开始出现白化征兆。6月,9号、11号两个较小的珊瑚样品出现白化。7月,9号、11号样品死亡,珊瑚呈灰白色,无触手伸展(图3 f、h);6号、10号样品开始白化。8月,6号、10号样品死亡;5号样品出现轻微白化;其余样品均出现严重白化(图3 f)。9月,样品全部死亡(表3)。至2014年2月,死亡后的珊瑚均未出现重新生长的迹象。
图3
图3
移植试验的珊瑚形态
注:a.试验珊瑚样品(2012-11-16);b.试验珊瑚样品(2013-02-22);c.珊瑚水下形态(2013-04-23);d.珊瑚水下形态(2013-05-24);e.测量珊瑚(2013-05-24);f.珊瑚出现白化(2013-08-21);g.珊瑚样品上多种附着生物(2013-01-25);h.附着生物与死亡珊瑚(2013-06-24)。
Fig.3
The coral morphology of transplantation experiments
Notes:a.Test coral samples(2012-11-16);b.Test coral samples(2013-02-22);c.Underwater form of coral(2013-04-23);d.Underwater form of coral(2013-05-24);e.Measuring corals(2013-05-24);f.Whitening of corals(2013-08-21);g.Multiple attachment organisms on coral samples(2013-01-25);h.Attached organisms and dead corals(2013-06-24).
表3 珊瑚移植试验中不同时间珊瑚长度变化表
Tab.3
| 样品号 Sample number | 2012- 11-16 | 2012- 12-11 | 2013- 01-25 | 2013- 02-22 | 2013- 03-26 | 2013- 04-23 | 2013- 05-24 | 2013- 06-24 | 2013- 07-20 | 2013- 08-21 | 2013- 09-28 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 13 | 17 | 19 | 19 | 19 | 20 | 21 | 21 | 21 | * | ** |
| 2 | 12 | 15 | 17 | 19 | 19 | 19 | 19 | 19 | 22 | * | ** |
| 3 | 20 | 21 | 21 | 21 | 21 | 21 | 22 | 23 | 23 | * | ** |
| 4 | 65 | 65 | 66 | 66 | 69 | 75 | 75 | 76 | 76 | * | ** |
| 5 | 15 | 18 | 19 | 22 | 24 | 26 | 27 | 28 | 28 | 28 | ** |
| 6 | 14 | 19 | 19 | 20 | 20 | 20 | 20 | 20 | * | ** | ** |
| 7 | 10 | 12 | 14 | 15 | 15 | 15 | 15 | 16 | 16 | * | ** |
| 8 | 13 | 15 | 17 | 18 | 19 | 19 | 20 | 20 | 20 | * | ** |
| 9 | 12 | 12 | 13 | 14 | 14 | 16 | 16 | * | ** | ** | ** |
| 10 | 15 | 15 | 16 | 18 | 18 | 18 | 19 | 19 | * | ** | ** |
| 11 | 5 | 5 | 5 | 5 | 5 | 6 | 6 | * | ** | ** | ** |
注:*珊瑚出现白化;**珊瑚死亡。
Notes:*Coral bleaching;**Coral death.
2.3 珊瑚的生长状况
2012年11月,移植珊瑚高度为5~65 mm,其中10 mm以下的样品1个,10~20 mm的样品8个,20 mm及以上的样品2个(表3)。
逐月测量结果表明,大部分移植珊瑚于2012年11月至2013年2月期间生长较快,平均生长速度达 15.6 mm/a。2013年3月至2013年8月期间,移植珊瑚生长速度明显减慢。
从试验观测结果统计,猩红筒星珊瑚生长速度约8.2 mm/a。
3 讨论
3.1 珊瑚的采集、运输方法及移植点的选取
3.1.1 珊瑚的采集和运输
目前珊瑚移植的方法主要有两种,一是将健康的珊瑚移入退化过程中的珊瑚礁,目的是促进造礁石珊瑚群落的恢复;二是将受到影响的珊瑚移植到新的海区中,目的是保护现有的珊瑚种群,一般称其为迁地保护[6]。珊瑚移植主要用于恢复被破坏的珊瑚礁或珊瑚群落、加速人工鱼礁及其生态系统的形成等。本文进行的珊瑚移植是将健康的珊瑚移植到新的海区,目的是在新的海区探索移植珊瑚,改善海底生态景观,为在海区开展潜水活动,丰富水下景观。
本研究移植珊瑚的开始半年内,珊瑚生长状况良好,颜色、形态未发生明显变化,没有发现珊瑚死亡现象,说明样品采取、运输、移植等所运用的方法、过程是可行的。
3.1.2 移植点的选取
移植区必须选择人类活动干扰少的海域。海湾及大陆沿海海域海洋开发活动强度大,不利于珊瑚移植试验。岛屿周边浅海岩礁区适宜珊瑚附着栖息,可作为珊瑚移植试验区,但是由于沿海渔民长期从事养殖、捕捞,尤其是在岩礁区放置笼网捕捞,在捕捞过程中笼网的放置、收取等对海底地形、底质等拖拽扰动,影响海底表层附着生物的生存条件,尤其是附着在海底岩礁上的珊瑚易受捕捞网具的拖拽而折断、脱落、死亡。
3.2 影响移植珊瑚存活和生长的主要因素
3.2.1 海洋环境因子
海水温度、盐度、浑浊度、透明度等环境因子是石珊瑚存活与生长的重要生态条件。石珊瑚对海水温度、盐度、浑浊度等环境因子的波动反应比较敏感,在其适宜的波动范围内存活、生长,如果超出其适应的范围,则生长将受到一定程度的抑制,而超出其阀值时可导致死亡。石珊瑚生长需要一定的生态环境条件,造礁石珊瑚比非造礁石珊瑚对生态环境条件的要求更为苛刻。海水温度是造礁石珊瑚分布最重要的生态因子,一般为18~30℃,最适宜的水温为25~29℃,13℃是致死温度[24]。造礁石珊瑚的盐度适应范围为27~40,最适盐度为34~36[25]。非造礁石珊瑚适宜海水温度8.5~20.0℃、盐度大于34[26];目前缺少石珊瑚存活与生长影响因素的具体量值关系。
试验结果表明在同安湾海域猩红筒星珊瑚存活与生长受海水温度、盐度、浑浊度、阳光、附着生物等诸多因素影响。冬季是海水温度最低季节,底层水温最低14.48℃,从冬季珊瑚存活、生长测量记录分析,该海域海水温度适宜珊瑚生长与存活,不会导致珊瑚死亡。同安湾海域冬季、春季、夏季、秋季底层盐度分别为28.90、26.68、30.23、30.07,盐度垂直变化特征为冬季、春季和秋季总体上属于冬季型,即盐度基本不随深度改变,垂直均匀分布,而夏季其深水区存在微弱的盐跃层,浅水区基本处于垂直均匀分布;雨季时暴雨导致大量径流入海,影响海水盐度,雨季底层最低盐度为26.19[20]。试验结果显示在低盐胁迫下,珊瑚产生不同的生态响应,当盐度低于28时出现白化征兆,低盐持续一段时间会导致珊瑚严重白化、死亡,制约珊瑚存活,表明移植的珊瑚对海水盐度的耐受性较低。
同安湾海域2月、5月、9月、11月底层平均悬浮泥沙含量分别为0.007 7、0.009 7、0.026 6、0.006 0 kg/m3,不会对珊瑚造成严重影响[20]。试验期间试验海区的海水浊度变化没有导致珊瑚白化死亡现象。
多种因素都会直接影响到移植石珊瑚的存活与生长,从本试验结果来看,虽然不能定量每种因素的影响程度与致死阈值,但可以获得该海域移植石珊瑚死亡的制约因素,即暴雨时期大量径流入海导致海水盐度骤降所致。
虽然猩红筒星珊瑚分布较广,在福建沿海及厦门湾海域均有分布,但在移植试验区同安湾海域之前的调查中都没有记录到该石珊瑚,试验结果表明在同安湾海域自然环境条件下猩红筒星珊瑚不能正常生长、存活。
3.2.2 附着生物
4 结论
选择合适的试验点是提高石珊瑚移植存活率的关键因素,本次试验结果表明,在海湾内移植猩红筒星珊瑚受盐度波动影响最为明显,大暴雨后入海河流向海湾注入大量径流,使得海水盐度明显降低,限制珊瑚生长与存活。其次是附着生物在一定程度上抑制珊瑚的生长、存活。而同安湾海域的海水温度、浊度正常波动不会导致珊瑚白化、死亡。
今后在进行珊瑚移植时,应科学分析环境特征对于移植石珊瑚的潜在影响,尽可能选择适宜的有利条件,如底质、海水温度、盐度、浑浊度、附着生物、人类活动等,提高移植珊瑚的存活率,达到移植目的。关于珊瑚生长、白化、死亡与影响因素的关系程度有待于今后深入试验研究。
参考文献
Building a coral reef in southeast Florida
[J].
Restoration strategies for coral reefs damages by recreational activities:the use of sexual and asexual recruits
[J].
Coral transplantation:regeneration and growth of Acropora fragments in a nursery
[J].
Coral relocation for impact mitigation in Northern Qatar
[R].
厦门市海岛资源综合调查专业报告集(第二卷)之厦门湾大型底栖生物
[R].
厦门文昌鱼自然保护区资源现状及其变动原因分析
[J].本文根据2019年8月(夏季)和11月(秋季)、2020年1月(冬季)和2021年4月(春季)在厦门文昌鱼自然保护区进行的4个季度文昌鱼资源现状调查研究,并结合历史调查数据资料分析了厦门文昌鱼资源变动原因。结果表明:调查期间厦门文昌鱼平均体长为29.71 mm,平均体质量为68.0 mg,主要以 2 龄(39.7%)和3龄(36.5%)为主,合占76.2%,4个季度文昌鱼体长和体质量均值均有显著性差异。保护区4个海区中,实验区鳄鱼屿海区文昌鱼的平均栖息密度最高,为50.0 ind/m2,但分布范围狭小;核心区黄厝、南线-十八线和小嶝岛-角屿岛海区平均栖息密度分别为4.1、1.5、0.4 ind/m2,与历史调查数据相比下降较为显著,尤其小嶝岛-角屿岛海区文昌鱼资源密度下降最为严重。栖息地环境变化是导致厦门文昌鱼保护区适宜生存场所缩小、资源衰退的最主要原因。
厦门湾大型底栖动物多样性指数空间分布及其与环境因子的关系
[J].为研究厦门湾大型底栖动物生物多样性指数的空间分布状态,及其与环境因子的相关性,于2012年8月对厦门湾海域大型底栖生物进行调查采样,对各站位种类数、多样性指数H’、 AZTI海洋生物指数AMBI和多变量AZTI海洋生物指数M-AMBI进行计算分析,并利用SPSS软件计算各指数与环境因子间的相关关系。结果表明:调查海区大型底栖动物共出现8门103种,各站位种类数平均值为11种,多样性指数H’平均值为2.328,AMBI平均值为1.739,M-AMBI平均值为0.538。各站位种类数与有机碳、盐度、pH、溶解氧、化学需氧量之间有显著或极显著相关关系,各站位AMBI与硫化物、盐度、石油类之间有显著或极显著相关关系。各站位多样性指数H’和M-AMB值与硫化物、石油类、有机碳、盐度、pH、溶解氧、化学需氧量间均存在显著或极显著相关关系。