仿刺参(Apostichopus japonicus)是棘皮动物门海参纲刺参科动物的统称,具有较高的营养、药用和经济价值。仿刺参属于温带种类,自然分布区域北起俄罗斯远东地区,经朝鲜、韩国、日本,南至中国北部,虽然在福建的自然海区无分布,但其所具有的巨大经济价值推动该品种养殖业从北往南扩张[1]。自2005年以来,福建省从辽宁等地引进仿刺参,并大力开展“北参南养”实验。2022年福建海参产量达到45 636 t,占全国总产量的18.36%,稳居全国第三位。
仿刺参为浅海底栖生物。水温是影响仿刺参生长、生理性能和免疫反应等功能的重要环境因素,并且在水温升高到一定范围后,其立即进入摄食停止、活动减少的“夏眠”状态。福建地区夏季的高温会导致养殖仿刺参发生大规模死亡,这给养殖业造成巨大的损失。目前,缺乏仿刺参耐高温良种是制约该产业进一步发展的重要因素。选择育种是获得水生动物新品系的重要方法[2⇓-4]。研究证明,热胁迫刺激能够一定程度地提高动物耐高温的能力[5⇓-7]。热休克蛋白(Heat shock proteins,HSPs)和小热休克蛋白(Small heat shock proteins,sHSPs)作为细胞内的分子伴侣,能够防止蛋白质在细胞内聚集,提高细胞的耐热能力[8⇓⇓⇓⇓-13]。以往研究表明,HSPs是诱导耐热的主要介质,其表达模式与生物体的耐热水平直接相关[14⇓⇓⇓-18]。此外,致死必需蛋白 [Protein lethal (2) essential for life, Protein l(2)efl]基因也是一种小热休克蛋白的同源基因,其表现出与sHSPs类似的功能,主要与生物的耐热能力有关,并在一定程度上保护细胞免于凋亡。HSP26、gp96、HSP70、HSP90a和proteinl(2)efl基因均属于热休克蛋白家族的成员,其表达的水平可用于评估高温诱导下仿刺参的热耐受力。
本研究从山东青岛购入仿刺参幼苗,将其饲养于温度较高的福建漳州户外浅池塘中,使其经历长期的高温海水刺激,以此作为南移福建养殖的仿刺参实验组,并以北方相同苗龄的仿刺参作为对照组,比较两组间的抗热性能,以期为仿刺参耐高温品系的培育提供理论参考。
1 材料与方法
1.1 实验动物和驯化
2016年冬季从山东省青岛市即墨养殖场(36°30'43.5″N、120°50'59.0″E)购买仿刺参幼苗,并将其分至两地养殖,一部分放在原养殖场养殖,另一部分转移到福建省漳州市东山养殖场室外饲养浅池塘进行养殖(23°34'34.1″N、117°23'28.8″E),两地养殖的仿刺参均在自然光周期和水温下饲养一年。海水经砂滤过滤,盐度约为30,以流水模式进行养殖。仿刺参幼苗每天投喂饲料一次,每次喂足人工海参饲料(金派生物,中国威海),并定期对池塘吸污。同时,每天记录水温情况,每月测定仿刺参幼苗的生长情况。2017年冬季,分别将青岛市即墨养殖场和漳州市东山养殖场养殖的仿刺参运至厦门市进行实验,此时仿刺参均为20月龄(600日龄)。为了方便后续区分,将两地运回的仿刺参分别简易命名为青岛本地群体(Qingdao local sea cucumber populations,Qls)和南方养殖群体(South aquaculture sea cucumbers populations,Sas)。实验开始前,将两地运来的仿刺参分别移入温度为16 °C的养殖水槽中,暂养14 d,每天换掉1/3~1/2的等温海水,其他饲养条件均相同。
1.2 实验设计
1.2.1 仿刺参温度耐受范围实验
为研究给定处理时间的仿刺参温度耐受范围,急性温度实验设计的刺激温度超过仿刺参养殖过程中海水的自然温度。将不同仿刺参群体分别放入预先调好海水温度的40 L透明塑料桶,每个塑料桶放入10头仿刺参,每个实验温度设置3个重复。将两个群体的仿刺参分别同时放入水温为28、29、30、31、32、33、34 °C的塑料桶中,经过2 h的温度刺激后,转移至16 °C养殖水槽中暂养7 d,观察记录其存活情况,以确定两个仿刺参群体的亚致死温度、致死温度和半致死温度。实验水温由温控器控制调节,实验期间每2 min用精度为±0.2 °C的水银温度计监测水温情况。在实验期间,仿刺参的饲养条件与驯化期间相似。
1.2.2 仿刺参温度耐受性相关基因的差异表达实验
为了解不同诱导温度和处理时间下两个仿刺参群体HSPs、sHSPs和proeintl(2)efl基因的表达模式差异,将两个群体分别转入选定的温度中进行热刺激,温度设置为16 (对照组)、30、31、32、33、34 °C,刺激时间分别为1、2、3 h。每个刺激温度和刺激时间均有10头仿刺参,在刺激1、2、3 h后,分别随机采集不同实验组别中的3头仿刺参,然后立即置于液氮中,带回实验室并保存在-80 °C冰箱中,备用待测。
1.3 RNA提取和cDNA的合成
将整头仿刺参置于装有液氮的研钵中碾碎。取约80 mg样品,放入1 mL Trizol试剂(Qiagen)中进行匀浆,再使用 Invitrogen 公司的 Trizol 试剂盒,按照说明书提取样本组织的总RNA。利用QuantScript RT Kit,按照说明书合成cDNA,提取的样品保存在-80 ℃冰箱中,备用待测。
1.4 引物设计和荧光定量实验
根据NCBI(http://www.ncbi.nlm.nih.gov/Genbank/)网站上已公布的HSP90a、HSP26、HSP70、gp96和proeintl(2)efl基因为模板设计荧光定量引物(表1)。采用荧光定量 PCR的方法,检测5个温度耐受性相关基因在温度刺激后的不同仿刺参幼苗群体中的表达情况。以β-actin的表达量为标准值,将对照组和实验组个体在不同时间点的表达量进行校正,以消除不同个体对实验结果的影响[26-27]。再将这些校正后的表达量与对照组(16 °C)进行比较,分析各基因在对照组和实验组中的倍数变化,从而发现基因在高温刺激后的表达规律。荧光定量PCR的反应条件为95 ℃预变性10 s、40个循环中95 ℃变性5 s、60 ℃退火34 s。
表1 本研究中所使用的引物
Tab.1
| 基因 Genes | 引物 Primers | 序列 Sequences (5'-3') |
|---|---|---|
| HSP90a | HSP90a-F | TTGTTGAAAGGGAGGAGG |
| HSP90a-R | GGCATCAGAGGCGTTAGA | |
| HSP26 | HSP26-F | TCCATCATTTGGCCTTCAGCGTA |
| HSP26-R | CATCAAACTCGTCATCGGCAAGC | |
| HSP70 | HSP70-F | GACACCACTTCAAAGACACC |
| HSP70-R | ATCATCAACGAACCTACCGC | |
| gp96 | gp96-F | GTTGAAAGGGAGGAGGAAG |
| gp96-R | GGCATCAGAGGCGTTAGA | |
| proeintl- (2)efl | proeintl- (2)efl-F | TGGCATTAGCCGAACAGT |
| proeintl- (2)efl-R | TTCGTCGTCGGATTCATAAC | |
| β-actin | β-actin-F | CGGGAAATCGTTCGTGACA |
| β-actin-R | AGGACAAAGTTGGCGTACA |
1.5 统计学分析
2 结果与分析
2.1 不同仿刺参幼苗群体的温度耐受性
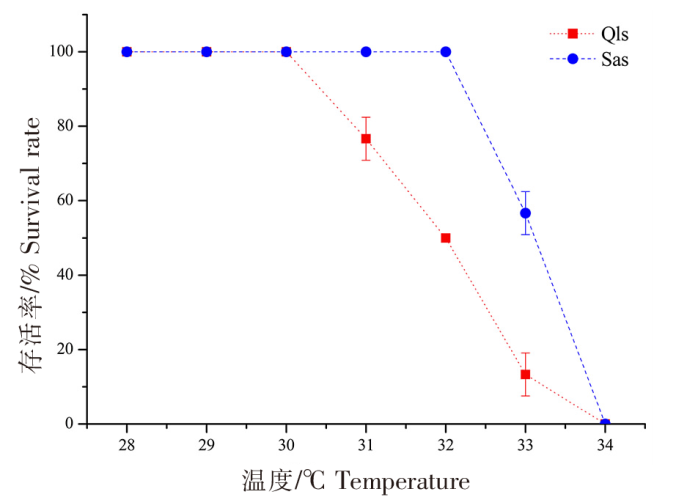
青岛本地群体和南方养殖群体在高温刺激后的存活率如图1所示。青岛本地群体在28~30 ℃高温刺激2 h后均没有出现死亡,而南方养殖群体在28~32 ℃高温刺激2 h后没有出现死亡,但两个群体在经过34 ℃高温刺激2 h后均全部死亡。在31~33 ℃高温刺激组中,南方养殖群体的存活率均高于青岛本地群体,其中青岛本地群体在31、32、33 ℃温度下刺激2 h后的存活率分别为76.7%±5.8%、50.0%±0.0%、13.3%±5.8%,而南方养殖群体分别为100.0%±0.0%、100.0%±0.0%、56.7%±5.8%,两个群体的存活率差异显著(P<0.05)。因此,高温刺激2 h后,青岛本地群体和南方养殖群体的亚致死温度分别为30、32 ℃,半致死温度(ULTs50)分别为31.9 ℃ (31.4~32.4 ℃) 和33.1 ℃ ( 32.6~33.5 ℃),两个群体的致死温度均为34 ℃(图1)。
图1
图1
不同仿刺参幼苗群体在高温热刺激后的存活率
Fig.1
Survival rate of different populations of A. japonicus seedlings after high temperature and heat stimulation
2.2 HSP90a基因的表达情况
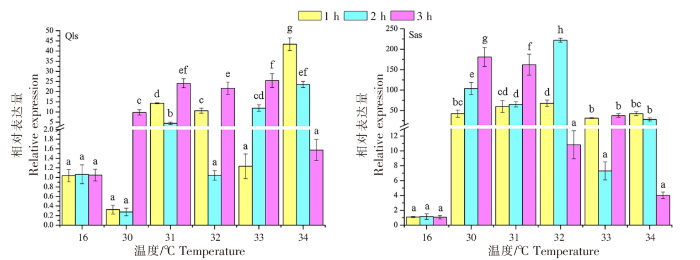
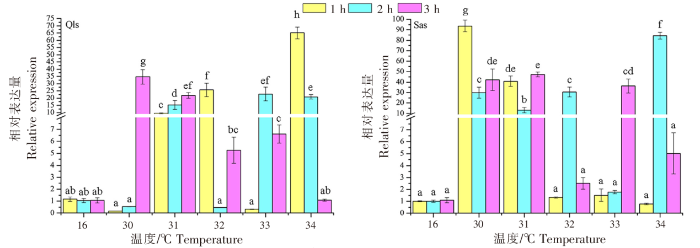
不同仿刺参幼苗群体在高温热刺激后的HSP90a基因的表达变化差异如图2所示。青岛本地群体经30、31、32、33 ℃高温刺激后,HSP90a基因的表达量峰值出现在温度刺激3 h处,分别为(9.801±1.303)、(24.133±2.232)、(21.683±3.082)、(25.473±3.402);而在34 ℃高温刺激后,HSP90a基因的表达量高峰发生在1 h处,此时达到青岛本地群体表达量的最高值(43.367±3.137),随后表达量随着温度刺激时间的延迟而出现降低。南方养殖群体经30 ℃高温刺激1 h后,HSP90a基因的表达量已达到(42.000±8.798);在30、31、33 ℃高温刺激下,HSP90a基因的表达峰值出现在温度刺激3 h处,而32 ℃高温刺激的最高表达值出现在2 h,此时达到南方养殖群体表达量的最高值(222.150±4.980)。在34 ℃的高温刺激下,南方养殖群体和青岛本地群体的表达模式相近,HSP90a基因的表达高峰均发生在1 h处。青岛本地群体在高温刺激1、2、3 h后,HSP90a基因的表达峰值分别出现在34、34、33 ℃;而南方养殖群体则分别出现在32、32、30 ℃。
图2
图2
不同仿刺参幼苗群体在高温热刺激后的HSP90a基因的表达变化差异
注:标有不同小写字母表示差异显著(P<0.05),标有相同小写字母表示差异不显著(P>0.05)。以下同此。
Fig.2
Changes of HSP90a gene expression in different populations of A. japonicus seedlings after heat stimulation
Notes:Different lowercase letters indicated significant difference (P<0.05),while the same lowercase letter meant no significant difference (P>0.05).The same as below.
2.3 gp96基因的表达情况
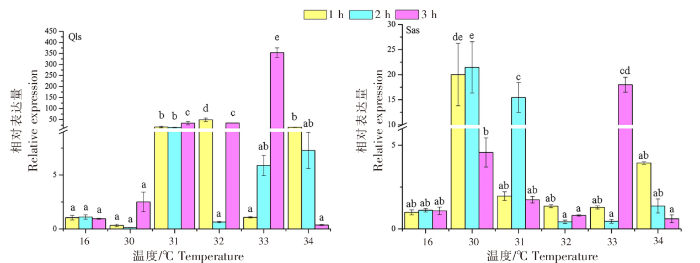
不同仿刺参幼苗群体在高温热刺激后的gp96基因的表达变化差异如图3所示。青岛本地群体在30 ℃高温刺激下1、2 h处,gp96基因的表达量显著低于对照组(16 ℃),而在刺激3 h后,表达量才上调并达到峰值(2.508±0.910);在31 ℃高温刺激下,gp96基因的表达量在1、2、3 h处均出现显著上调,并在3 h处出现表达量峰值;在32 ℃高温刺激下,gp96基因的表达量在温度刺激1 h后出现大幅增加,并达到峰值,随后在2、3 h处表达量分别出现明显的下调和上调;在33 ℃高温刺激下,gp96基因的表达量随着高温刺激时间的延长而增加,在3 h处表达量达到青岛本地群体的最高值(353.833±21.586);在34 ℃高温刺激下,gp96基因的表达量随着温度刺激时间的延长而降低。
图3
图3
不同仿刺参幼苗群体在高温热刺激后gp96 基因的表达变化差异
Fig.3
Changes of gp96 gene expression in different populations of A. japonicus seedlings after heat stimulation
南方养殖群体在30 ℃高温刺激1 h后,gp96基因的表达量已达到(20.019±6.224),并在2 h处达到峰值,此时也是南方养殖群体表达量的最高值(21.467±5.131),最后在3 h处出现下降;在31 ℃高温刺激下,gp96基因的表达模式与30 ℃高温刺激下的相同,呈现先升高后下降的趋势;在32 ℃高温刺激下,gp96基因的表达量在1 h处出现上调,但在2~3 h间出现上下浮动;在33 ℃高温刺激下,gp96基因的表达量在1~3 h间来回波动,最高和最低表达值分别出现在2、3 h处;在34 ℃高温刺激下,gp96基因的表达量在1 h处达到最高,之后表达量随着高温刺激时间的延长而逐渐降低。
青岛本地群体在高温刺激1、2、3 h后,gp96基因的表达量峰值分别出现在32、31、33 ℃;而南方养殖群体则分别出现在30、30、33 ℃。
2.4 HSP70基因的表达情况
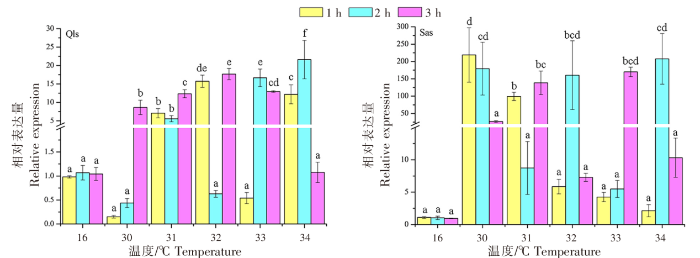
不同仿刺参幼苗群体在高温热刺激后的HSP70基因的表达变化差异如图4所示,在相同的温度刺激下,不同刺激时间的HSP70基因的表达存在差异。青岛本地群体在30、31、32 ℃高温刺激下,HSP70基因的表达量均在3 h处达到峰值,分别为(8.649±1.936)、(12.350±1.076)、(17.680±1.532);而在33、34 ℃高温刺激下,HSP70基因的表达量峰值均出现在2 h处;表达量的最高值出现在34 ℃刺激2 h处,为(21.610±5.208)。南方养殖群体在30 ℃高温刺激下,HSP70基因的表达量在1 h处达到峰值,也是该群体表达量的最高值,为(218.750±78.701);而在31、33 ℃高温刺激下,HSP70基因的表达量峰值均出现在3 h处;在32、34 ℃高温刺激下,HSP70基因的表达量峰值均出现在2 h处。青岛本地群体在高温刺激1、2、3 h后,HSP70基因的表达量峰值分别出现在32、34、32 ℃;而南方养殖群体则分别出现在30、34、33 ℃。
图4
图4
不同仿刺参幼苗群体高温热刺激后HSP70基因的表达变化差异
Fig.4
Changes of HSP70 gene expression in different populations of A. japonicus seedlings after heat stimulation
2.5 HSP26基因的表达情况
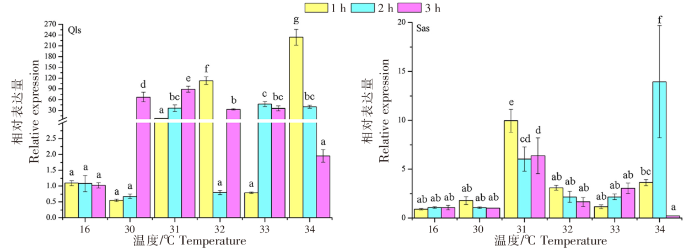
不同仿刺参幼苗群体在高温热刺激后的HSP26基因的表达变化差异如图5所示。青岛本地群体经过30 ℃高温刺激,HSP26基因的表达量在1 h处出现明显的降低,然后在2 h处继续降低,但在3 h处达到峰值(34.787±4.978);在31 ℃高温刺激下,HSP26基因的表达量在1 h处出现显著上升,之后随着刺激时间的延长而继续上调;在32 ℃高温刺激下,HSP26基因的表达量在1 h处达到高峰,在2 h处降低到正常水平,之后在3 h处又出现升高;在33 ℃高温刺激下,HSP26基因的表达量在1 h处出现显著下调,之后在2 h处出现大幅增加并达到峰值,之后在3 h处出现迅速降低;在34 ℃高温刺激下,HSP26基因的表达量在1 h处迅速上调并达到该群体表达量的最高值(65.127±4.054),之后逐渐降低到正常水平。南方养殖群体的HSP26基因的表达量在30、31 ℃高温刺激下出现显著的上调,但是表达量峰值不同,最高值出现在30 ℃刺激1 h处,为(93.710±5.674);在33 ℃高温刺激下,HSP26基因的表达量随着刺激时间的延长而增加,在3 h处出现表达量峰值;HSP26基因的表达在32、34 ℃高温刺激下的表达模式相近,即高温刺激1 h处的表达没有显著差异,而在2 h处的表达量出现快速上调并达到最高峰,之后恢复正常水平。青岛本地群体在高温刺激1、2、3 h后,HSP26基因的表达峰值分别出现在34、33、30 ℃;而南方养殖群体则分别出现在30、34、31 ℃。
图5
图5
不同仿刺参幼苗群体在高温热刺激后的HSP26基因的表达变化差异
Fig.5
Changes of HSP26 gene expression in different populations of A. japonicus seedlings after heat stimulation
2.6 proeintl(2)efl基因的表达情况
不同刺参幼苗群体在高温热刺激后的proeintl(2)efl基因的表达变化差异如图6所示。青岛本地群体经过30、31 ℃的高温刺激后,proeintl(2)efl基因的表达量峰值出现在3 h处,分别为(67.230±13.512)、(88.897±8.242);在32、34 ℃高温刺激下,proeintl(2)efl基因的表达量峰值均出现在1 h处,表达量的最高值出现在34 ℃刺激1 h处(234.167±22.130);而在33 ℃高温刺激下,proeintl(2)efl基因的表达量峰值出现在高温刺激2 h处。南方养殖群体经过30、31、32℃高温刺激后,proeintl(2)efl基因的表达峰值均出现在1 h处;而33、34 ℃高温刺激下,proeintl(2)efl基因的表达量峰值则分别出现在3、2 h处,表达量的最高值出现在34 ℃刺激2 h处(13.948±5.740)。青岛本地群体在高温刺激1、2、3 h后,proeintl(2)efl基因的表达峰值分别出现在34、33、31 ℃;而南方养殖群体则分别出现在31、34、31℃。
图6
图6
不同刺参幼苗群体在高温热刺激后的proeintl(2)efl基因的表达变化差异
Fig.6
Changes of proeintl(2)efl gene expression in different populations of A. japonicus seedlings after heat stimulation
3 讨论
3.1 高温驯化提高仿刺参的耐热性
仿刺参是典型的温带物种,对外界环境变化具有强敏感性。Meng X等[27]和王青林[32]对北方仿刺参进行高温驯化,结果发现高温驯化后仿刺参的半致死温度为31.8 ℃。本研究将北方仿刺参转移至南方,在自然水温下进行为期一年的养殖,然后与在北方养殖的同批次仿刺参进行耐热性比较,分析了两个群体间的耐热性差异,其中温度耐受性实验得出两个群体的致死温度均为34 ℃;南方养殖群体的亚致死温度和半致死温度分别为32、33.1 ℃,青岛本地群体分别为30、31.9 ℃。本研究发现的青岛本地群体半数致死温度与Meng X等和王青林的结论基本一致。李晓英等[33]比较了北方5个不同地理群体仿刺参的高温耐受力,结果发现胶南群体的半致死温度最高(31.9 ℃),而昌黎群体半致死温度最低(31.5 ℃),分析认为胶南群体分布靠南、纬度最低,经过长时间较高温度的驯化与适应,使其对于高温的耐受力最强,而昌黎群体分布位于较北端、纬度较高,长期处于略微低温驯化中,导致其对高温的耐受能力较弱。本研究发现,南方养殖群体的亚致死温度和半致死温度显著高于青岛本地群体,这与李晓英等[33]的研究一致,说明生长环境中水温的高低能够影响仿刺参的温度耐受性,而受到长期高温驯化的仿刺参具有更强的高温耐受性。养殖在南方自然水温中的仿刺参幼苗比北方苗种经历更强的高温胁迫,因此其相较于北方苗种具有更高的耐热性。今后在仿刺参品种选育工作中可以通过在南方累代定向选育,不断提高其耐热性能,从而迭代选育出耐高温品系。
3.2 南北不同养殖仿刺参群体的热休克蛋白基因的表达差异
当生物体受到外界环境刺激时,包括热休克蛋白在内的一些基因的表达可能被诱导。根据平均分子质量大小,热休克蛋白可分为HSP110、HSP100、HSP90a、HSP70、HSP60和sHSP[15,34 -35]。本研究发现,经过高温热刺激后,南方养殖群体和青岛本地群体的HSP90a、gp96、HSP70、HSP26和proeintl(2)efl基因的表达存在差异。经过30 ℃高温刺激的青岛本地群体的HSP90a、gp96、HSP70、HSP26基因的表达量在1、2 h处没有出现显著增加,在3 h处才出现明显上调,而南方养殖群体的基因表达量在30 ℃高温刺激1 h处均出现显著上调。结果表明经过高温热刺激后,南方养殖群体的温度耐受性相关基因的上调时间明显早于青岛本地群体,说明南方养殖群体对高温热刺激的适应能力强于青岛本地群体。
在不同的刺激温度下,青岛本地群体和南方养殖群体的HSP90a、gp96、HSP70、HSP26和proeintl(2)efl基因的表达量峰值发生在不同的高温热刺激时间点,青岛本地群体的表达峰值分别出现在34 °C 1 h处、33 °C 3 h处、34 °C 2 h处、34 °C 1 h处和34 °C 1 h处,而南方养殖群体则分别出现在32 °C 2 h处、30 °C 2 h处、30 °C 1 h处、30 °C 1 h处和34 °C 2 h处。随着热刺激温度的升高或时间的延长,基因表达并非一直上调,这种下降与高温下生物体整体蛋白质合成的减少有关[36]。当外界温度达到生物体的耐受极限,随着温度的进一步升高,机体热损伤蛋白质会不断增加,总蛋白质合成遭到破坏,因此热休克蛋白的表达受到抑制。
对比南方养殖群体和青岛本地群体,HSP90a基因在南方养殖群体的表达量最高值(为对照组的222倍)是青岛本地群体(为对照组的43倍)的5倍,HSP70基因在南方养殖群体的表达量最高值(为对照组的218倍)是青岛本地群体(为对照组的21倍)的10倍,这与王青林[32]研究发现的仿刺参高温驯化组HSP70基因在热刺激诱导温度下的最高表达量明显高于低温驯化组的结果一致,说明经过高温驯化的仿刺参能保持较高水平的HSP70表达,以防止蛋白质变性和聚集。 此外,HSP90a、gp96、HSP70、HSP26和proeintl(2)efl这5个基因在两个仿刺参群体的34 ℃高温刺激3 h处的表达量均下调至对照组水平,说明此时仿刺参HSPs基因的表达已达到上限并开始迅速回落,其已无法通过继续提高HSPs基因的表达水平来抵抗外界的热胁迫,这与本研究两个群体的致死温度均为34 ℃的结果一致。
4 结论
经过高温驯化,仿刺参能够更早地对外界高温做出反应,同时其具有更强的合成热休克蛋白的能力,以避免温度骤升引起的蛋白质变性和聚集,从而提高它们在夏季高温下的耐热能力和存活率。因此,通过将仿刺参幼苗进行“北参南养”,经过几代的高温选育,能够为仿刺参耐高温品系的选育提供良好的实验材料。
参考文献
中国刺参(♂)×日本红刺参(♀)杂交子代的胚胎、幼体发育及幼参生长性状的研究
[J].
A new horizon for biological field stations and marine laboratories
[J].
Thermal tolerance and growth differences in orangethroat darter (Etheostoma spectabile) from thermally contrasting adjoining streams
[J].
Heat shock protein induction in the freshwater prawn Macrobrachium malcolmsonii:acclimation-influenced variations in the induction temperatures for Hsp70
[J].
Stress-inducible responses and heat shock proteins:new pharmacologic targets for cytoprotection
[J].Molecular chaperones protect proteins against environmental and physiologic stress and from the deleterious consequences of an imbalance in protein homeostasis. Many of these stresses, if prolonged, result in defective development and pathologies associated with a diverse array of diseases due to tissue injury and repair including stroke, myocardial reperfusion damage, ischemia, cancer, amyloidosis, and other neurodegenerative diseases. We discuss the molecular nature of the stress signals, the mechanisms that underlie activation of the heat shock response, the role of heat shock proteins as cytoprotective molecules, and strategies for pharmacologically active molecules as regulators of the heat shock response.
Protein folding in the cell:competing models of chaperonin function
[J].
Molecular chaperones:clasping the prize
[J].The three-dimensional structure of the substrate-binding domain of DnaK, a bacterial Hsp70, shows how such molecular chaperones can be so promiscuous in recognizing different proteins, yet so accurate in discriminating between unfolded and folded forms of their polypeptide substrates.
Molecular chaperones in protein folding and proteostasis
[J].
Chaperones get in touch:the Hip-Hop connection
[J].Recent findings emphasize that different molecular chaperones cooperate during intracellular protein biogenesis. Mechanistic aspects of chaperone cooperation are now emerging from studies on the regulation of certain signal transduction pathways mediated by Hsc70 and Hsp90 in the eukaryotic cytosol. Efficient cooperation appears to be achieved through a defined regulation of Hsc70 activity by the chaperone cofactors Hip and Hop.
Heat-shock proteins,molecular chaperones,and the stress response:evolutionary and ecological physiology
[J].
Phenotypic plasticity of HSP70 and HSP70 gene expression in the Pacific oyster (Crassostrea gigas):implications for thermal limits and induction of thermal tolerance
[J].
Thermotolerance and heat-shock protein expression in Northeastern Pacific Nucella species with different biogeographical ranges
[J].
Evolutionary and acclimation-induced variation in the heat-shock responses of congeneric marine snails (genus Tegula) from different thermal habitats:implications for limits of thermotolerance and biogeography
[J].Heat stress sufficient to cause cellular damage triggers the heat-shock response, the enhanced expression of a group of molecular chaperones called heat-shock proteins (hsps). We compared the heat-shock responses of four species of marine snails of the genus Tegula that occupy thermal niches differing in absolute temperature and range of temperature. We examined the effects of short-term heat stress and thermal acclimation on the synthesis of hsps of size classes 90, 77, 70 and 38 kDa by measuring incorporation of 35S-labeled methionine and cysteine into newly synthesized proteins in gill tissue. Temperatures at which enhanced synthesis of hsps first occurred (Ton), temperatures of maximal induction of hsp synthesis (Tpeak) and temperatures at which hsp synthesis was heat-inactivated (Toff) were lowest in two low-intertidal to subtidal species from the temperate zone, T. brunnea and T. montereyi, intermediate in a mid-to low-intertidal species of the temperate zone, T. funebralis, and highest in a subtropical intertidal species from the Gulf of California, T. rugosa. Synthesis of hsps and other classes of protein by T. brunnea and T. montereyi was heat-inactivated at temperatures commonly encountered by T. funebralis during low tides on warm days. In turn, protein synthesis by T. funebralis was blocked at the upper temperatures of the habitat of T. rugosa. Acclimation of snails to 13 °C, 18 °C and 23 °C shifted Ton and Tpeak for certain hsps, but did not affect Toff. The heat-shock responses of field-acclimatized snails were generally reduced in comparison with those of laboratory-acclimated snails. Overall, despite the occurrence of acclimatory plasticity in their heat-shock responses, genetically fixed differences in Ton, Tpeak and Toff appear to exist that reflect the separate evolutionary histories of these species and may play important roles in setting their thermal tolerance limits and, thereby, their biogeographic distribution patterns.
升温对‘水院1号’和大连养殖刺参非特异性免疫影响的研究
[J].为获知升温对“水院1号”和大连养殖刺参非特异性免疫酶活性及MDA含量的影响,实验设置不同温度梯度(16℃、20℃、24℃及28℃),分别对“水院1号”和大连养殖刺参体腔液中过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、溶菌酶(LSZ)的活性及丙二醛(MDA)含量进行测定。结果显示:(1)在升温过程中,“水院1号”和大连养殖刺参体腔液中CAT、SOD、POD活性均呈先升高后降低的趋势。“水院1号”和大连养殖刺参体腔液中CAT活性范围分别为77.160U/ml~151.76U/ml、24.617 U/ml~51.740 U/ml;SOD活性范围分别为0.070 U/ml~0.154 U/ml、0.056 U/ml~0.100 U/ml;POD活性范围分别为2.360 U/ml~3.470 U/ml、1.407 U/ml~ 2.407U/ml。“水院1号”和大连养殖刺参体腔液中LSZ活性均呈先升高再降低又升高的趋势,活性范围分别为9.741U/ml ~30.898U/ml 、8.554U/ml~28.006U/ml。“水院1号”刺参体腔液中MDA含量随着水温升高逐渐降低,其含量范围为42.331nmol/ml~46.563nmol/ml,大连养殖群体刺参体腔液中MDA含量呈先降低后升高的趋势,变化范围为46.079nmol/ml~47.329nmol/ml。(2)在升温过程中,“水院1号”刺参体腔液中CAT、SOD、POD和LSZ活性变化较大连养殖群体刺参的变化差异大,其中POD活性变化差异显著(P<0.05)。在28℃水温下,“水院1号”刺参MDA含量显著小于大连养殖群体刺参MDA含量(P<0.05)。研究表明,刺参能够对水温升高及时地做出生理免疫反应,通过调节非特异性免疫酶活性来清除机体内多余的活性氧,保护机体免受环境改变造成的损害。研究发现,“水院1号”刺参较大连养殖群体刺参反应更为灵敏,对高温的适应性更强。本研究为探讨刺参对高温适应性和对“水院1号”品种推广具有一定意义。
Effects of thermal and osmotic stress on growth,osmoregulation and Hsp70 in sea cucumber (Apostichopus japonicus Selenka)
[J].
Thermal resistance in sea cucumbers (Apostichopus japonicus) with differing thermal history:the role of Hsp70
[J].
闽南地区斜带石斑鱼 (Epinephelus coioides) 神经坏死病毒的基因型与分子进化研究
[J].本研究以闽南地区具有典型神经坏死病症状的斜带石斑鱼为材料,采用RT-PCR法对其进行病毒检测,对检测到的阳性序列进行双向测序和构建系统发育树,对病毒颗粒进行分离纯化,并通过分子进化模型分析病毒衣壳蛋白基因所受的选择压力。结果显示,采集到的6个石斑鱼样品均呈NNV 阳性,系统树分析发现6个样品的PCR扩增片段均为RGNNV基因型序列,表明闽南地区感染石斑鱼的神经坏死病毒主要为RGNNV基因型病毒;通过PEG法对病毒进行分离提純,获得直径为25~28 nm、呈二十面立体对称结构的无囊膜病毒 颗粒;分子进化分析显示NNV外壳蛋白基因经历了纯化选择,表明病毒在进化过程中没有 出现遗传变异并以相对恒定保守的速率进化。
神经坏死病毒疫苗免疫后3种免疫相关基因在斜带石斑鱼 (Epinephelus coioides) 组织中的表达研究
[J].感染神经坏死病毒 (Nervous necrosis virus, NNV) 会引起斜带石斑鱼 (Epinephelus coioides) 苗种大量死亡。病毒样颗粒 (Virus-like particles, VLPs)不含病毒基因组,被认为是一种最安全、有效的能够预防病毒病的疫苗。本研究以养殖的斜带石斑鱼为研究对象,分析了3种免疫相关基因(IFN、TNF-α和IRF3)在9种组织(心、肝、脾、肾、肠、鳃、血、眼和脑)中的表达量,并通过肌肉注射疫苗,检测这3种免疫相关基因在主要免疫组织(肝、脾和肾)中的表达变化情况。结果显示,IFN、TNF-α和IRF3基因在斜带石斑鱼的9种组织中都有表达,IFN、TNF-α和IRF3基因分别在脑、鳃和血中的表达量最高。单独疫苗免疫后,肝脏中IFN、TNF-α和IRF3基因,脾脏中IFN基因以及肾脏中IFN基因的相对表达量并没有提高,但注射添加CpG ODN(含CpG基序的寡核苷酸)佐剂的疫苗后,这些基因的相对表达量均出现上调。单独疫苗免疫能够提高其它组织中IFN、TNF-α和IRF3基因的表达值,但其最高表达量均小于相对应的佐剂+疫苗组,表明CpG寡核苷酸基序能够提高疫苗的免疫原性和机体的免疫反应能力,从而使疫苗发挥最大的免疫作用。
Role of the major heat shock proteins as molecular chaperones
[J].
SRC-1 and TIF2 control energy balance between white and brown adipose tissues
[J].We have explored the effects of two members of the p160 coregulator family on energy homeostasis. TIF2-/- mice are protected against obesity and display enhanced adaptive thermogenesis, whereas SRC-1-/- mice are prone to obesity due to reduced energy expenditure. In white adipose tissue, lack of TIF2 decreases PPARgamma activity and reduces fat accumulation, whereas in brown adipose tissue it facilitates the interaction between SRC-1 and PGC-1alpha, which induces PGC-1alpha's thermogenic activity. Interestingly, a high-fat diet increases the TIF2/SRC-1 expression ratio, which may contribute to weight gain. These results reveal that the relative level of TIF2/SRC-1 can modulate energy metabolism.