卤虫(Artemia)俗称丰年虫,又称盐水丰年虫、丰年虾等,是广泛分布于自然盐湖和人工盐池等高盐度水域中的小型甲壳类动物[1]。卤虫含有丰富的氨基酸、脂肪酸等营养物质[2],同时因价格合适、容易获取并能够稳定供应,而被广泛作为海水鱼类和虾蟹类苗种培育的生物饵料[3-4]。但是因生活环境条件的差异,不同的品系、产地来源和采收时间的卤虫卵和卤虫幼体在大小、营养组成等方面存在较大差异[5-6],特别是高度不饱和脂肪酸的含量已成为水产苗种培育中选择卤虫种类重要的影响因素[7-8]。在水产动物苗种培育中,通常是投喂卤虫无节幼体,或者是将卤虫无节幼体强化之后再使用,如作为日本川鲽(Paralichthys olivaceus)幼苗[9]、云龙石斑鱼(Epinephelus moara♀×E.lanceolatus♂)[10]和赤点石斑鱼(E.akaara)鱼苗[11]、凡纳滨对虾(Litopenaeus vannamei) [12]、匙吻鲟(Polyodon spathala)仔鱼[13]和罗氏沼虾(Macrobrachium rosenbergii)幼体[14]等的饵料,然而在水产动物苗种的生长中,使用卤虫后期幼体进行投喂也具有较高的现实意义。
卤虫是典型的非选择性滤食、杂食动物,如单细胞微藻、酵母和有机质碎屑等都可以用于卤虫的培养[15]。利用湛江叉鞭金藻(Dicrateria zhanjiangensis)、亚心形扁藻(Platymonas subcordiformis)和小球藻(Chlorella pyenoidosa)分别投喂卤虫幼体,5 d的培养结果显示,3种微藻均能促进卤虫幼体的生长[16];采用酵母粉为主要饵料开展的卤虫高密度养殖,经过17 d的养殖,获得了7.2 kg/m2卤虫产量的良好效果[17];利用麦糠微粒投喂卤虫 10 d,培养的卤虫幼体平均体长达到0.3 cm以上[18]。目前,有关饲养卤虫的研究大多集中在卤虫幼体营养强化、不饱和脂肪酸含量富集等方面,对多日龄卤虫养殖过程中的生长及其营养成分的综合评价较少。为进一步了解饵料对卤虫生长、存活和营养组成的影响,本研究采用3种饵料[酵母(Saccharomyces cerevisiae)、小球藻藻粉和发酵虾片]分别投喂孵化的卤虫无节幼体,统计分析其生长和存活情况,比较分析3种饵料饲养的卤虫幼体的营养成分,以期为卤虫的养殖、营养强化方式提供参考,也为卤虫在海水经济动物苗种培育中的应用提供科学依据。
1 材料与方法
1.1 试验材料
试验于2022年3—6月在福建漳州东山县逸昌水产养殖场苗种培育车间进行。卤虫卵和小球藻藻粉(粗蛋白40.6%、粗脂肪5.6%)由山东宏福水产养殖有限公司提供;酵母为湖南仁恒生物科技有限公司生产(蛋白质40.0%、粗脂肪4.3%);发酵虾片购于厦门市海林生物科技有限公司(粗蛋白45.2%、粗脂肪9.6%)。
1.2 卤虫孵化与养殖
1.2.1 卤虫孵化
卤虫卵放置于底部透光的500 L锥形桶中,放卵密度为1 g/L,孵化温度为28 ℃,24 h充气,溶解氧(DO)维持在4~5 mg/L,光照强度5 000~6 000 lx。经过24 h的孵化,检查发现大部分卤虫卵已经孵化之后,停止充气。除底部外,锥形孵化桶上部均遮光,静置10 min,根据卤虫的趋光性,利用150目的筛绢网在锥形孵化桶底部排水口处收集刚孵化的卤虫无节幼体(Ⅰ期卤虫无节幼体)。
1.2.2 卤虫养殖
卤虫养殖设计3个饵料组:酵母、小球藻藻粉、发酵虾片(虾片:酵母:水按照10:1:5密封发酵48 h),每种饵料均设置3个平行组,卤虫无节幼体按照1个/mL的密度接种于1 000 L养殖桶中。每天投喂3次(6:00、14:00、22:00),日换水量为20%,3种饵料初始每次每日投喂量均为10 g,之后每天投喂量增加20%。酵母经300目的筛绢网揉搓后再进行投喂;小球藻藻粉直接投喂;发酵虾片混匀后投喂,养殖周期均为6 d。试验用海水均为砂滤自然海水,试验期间pH为7.5~8.5,温度为(25±0.5) ℃,盐度为25,24 h充气,光照强度3 000~5 000 lx。
1.3 测定指标与方法
1.3.1 生长性状测量和存活率分析
随机取200只卤虫无节幼体,解剖镜下测量其体长,作为试验初始体长。试验组每隔2天随机取200只卤虫幼体在解剖镜下测量体长。试验结束时,将养殖桶卤虫样品混匀后,随机取样1 000 mL进行全部计数,计算存活率。
相关指标的计算方法如下:
式(1)~(3)中:L2为终末体长,μm;L1为初始体长,μm;t为投喂天数,d;N2为终末数量;N1为初始数量。
1.3.2 营养组成分析
本试验先取部分刚孵化的卤虫无节幼体进行清洗、过滤之后,将其冰冻保存、待测,其营养成分分析结果作为本底对照及与卤虫养殖试验结果的比较。至试验结束时,利用80目筛绢网收集所有养殖后的卤虫幼体,清洗干净、过滤之后,用于营养成分分析。水分测定参照GB 5009.3—2010直接干燥法;灰分测定参照GB 5009.4—2010马弗炉高温灼烧法;粗蛋白测定参照GB 5009.5—2010凯氏定氮法测定;粗脂肪参照GB/T 5009.6—2003索氏抽提法;氨基酸测定参照GB/T 5009.124—2003酸水解法;脂肪酸测定参照GB 5009.168—2016气相色谱法。
1.4 数据分析
试验数据采样SPSS.20进行统计,通过单因素方差分析比较不同组间的差异,组间两两比较采用最小显著法(Least-significant difference,LSD),P<0.05表示差异具有统计学意义,结果用平均值±标准差(
2 结果与分析
2.1 不同饵料组的卤虫幼体生长比较
采用酵母、小球藻藻粉和发酵虾片3种饵料对卤虫无节幼体进行6 d的养殖,各组卤虫幼体生长情况如表1所示。酵母组卤虫幼体生长最慢,体长为(1 070.75±84.32)μm;发酵虾片组卤虫幼体生长最快,体长为(1 234.54±102.32)μm;3种饵料对卤虫幼体生长速率的影响依次为酵母组<小球藻藻粉组<发酵虾片组,且不同饵料对卤虫幼体生长影响显著(P<0.05),发酵虾片组显著大于小球藻藻粉组和酵母组(P<0.05),小球藻藻粉组和酵母组差异不显著(P>0.05)。3个饵料组卤虫幼体体长增长量、增长率和特定生长率的变化均与体长变化一致。
表1 3种不同饵料对卤虫幼体生长的影响
Tab.1
| 饵料 Diets | 初始体长/μm Initial length | 终末体长/μm Final length | 体长增长量/μm Body length growth | 增长率/% Growth rate | 特定生长率/(%/d) Specific growth rate |
|---|---|---|---|---|---|
| 酵母 S.cerevisiae | 404.15±18.81 | 1 070.75±84.32b | 666.60±57.75b | 164.94±4.16b | 16.24±0.56b |
| 小球藻藻粉 Powder of C.pyenoidosa | 404.15±18.81 | 1 101.46±91.67b | 697.31±61.71b | 172.54±5.14b | 16.71±0.49b |
| 发酵虾片 Fermented shrimp flake | 404.15±18.81 | 1 234.54±102.32a | 830.39±86.08a | 205.47±8.02a | 18.61±0.69a |
注:同一列数据上标不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P >0.05)。下同。
Notes:Values in the same column with different letters were significantly different (P<0.05), the same letters indicated no significantly different (P>0.05).The same as below.
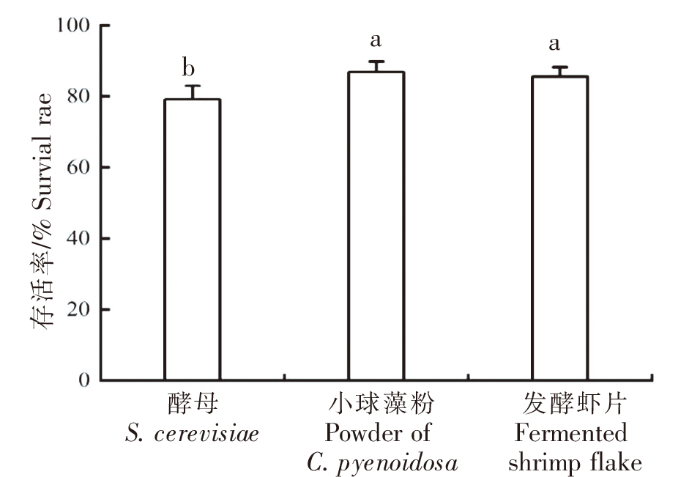
2.2 不同饵料组对卤虫幼体存活率的影响
卤虫幼体存活率情况如图 1 所示。小球藻藻粉组的卤虫幼体存活率最高,为(86.87±3.01)%;其次为发酵虾片组,为(85.73±0.50)%;酵母组最低,为(79.17±3.82)%。酵母组的卤虫幼体存活率与小球藻藻粉组、发酵虾片组均差异显著(P<0.05),小球藻藻粉组和发酵虾片组存活率差异不显著(P>0.05)。
图1
图1
投喂3 种不同饵料的卤虫幼体存活率
注:不同小写字母表示存在显著差异(P<0.05)。
Fig.1
The survival rates of Artemia nauplii fed with three different diets
Note:Values in each column with different letters were significantly different (P<0.05).
2.3 不同饵料组卤虫幼体常规营养成分
卤虫无节幼体和经3种饵料养殖的卤虫幼体常规营养成分见表2。卤虫无节幼体的粗蛋白质含量最低,为(52.68±0.303)%,显著低于酵母组、小球藻藻粉组和发酵虾片组(P<0.05);小球藻藻粉组和发酵虾片组卤虫的蛋白质含量显著高于酵母组(P<0.05)。卤虫无节幼体的粗脂肪含量最高,为(11.93±0.033)%,显著高于酵母组、小球藻藻粉组和发酵虾片组(P<0.05);3种饵料投喂的卤虫幼体的粗脂肪含量大小依次为发酵虾片组>小球藻藻粉组>酵母组。水分含量在各组中的大小依次为酵母组>发酵虾片组>小球藻藻粉组>卤虫无节幼体。卤虫无节幼体灰分含量最高,为(21.56±0.009)%,显著高于酵母组、小球藻藻粉和发酵虾片组(P<0.05),3种饵料投喂的卤虫灰分含量差异不显著(P>0.05)。
表2 卤虫无节幼体和经3种饵料养殖的卤虫幼体常规营养成分(干物质)
Tab.2
| 饵料 Diets | 粗蛋白Crude protein | 粗脂肪Crude fat | 水分Moisture | 灰分Ash |
|---|---|---|---|---|
| 卤虫无节幼体 Artemia nauplii | 52.68±0.303c | 11.93±0.033a | 90.65±0.183d | 21.56±0.009a |
| 酵母 S.cerevisiae | 63.19±0.551b | 8.65±0.056d | 93.33±0.103a | 10.92±0.053b |
| 小球藻藻粉 Powder of C.pyenoidosa | 66.50±0.231a | 9.76±0.333c | 91.88±0.046c | 11.49±0.007b |
| 发酵虾片 Fermented shrimp flake | 67.68±0.097a | 10.44±0.347b | 92.90±0.359b | 11.73±0.037b |
2.4 不同饵料组卤虫幼体氨基酸组成及含量
卤虫无节幼体和经3种饵料养殖的卤虫氨基酸组成及含量见表3。在卤虫无节幼体和3种饵料组卤虫中均检测到18种氨基酸。卤虫无节幼体的各氨基酸含量均显著低于3个饵料组(P<0.05)。酵母组卤虫幼体的丝氨酸含量显著低于小球藻藻粉组和发酵虾片组(P<0.05)。小球藻藻粉组卤虫幼体的色氨酸含量显著高于酵母组和发酵虾片组(P<0.05);酪氨酸含量显著高于发酵虾片组(P<0.05),但与酵母组差异不显著(P>0.05)。不同饵料组卤虫幼体的丙氨酸、精氨酸、天门冬氨酸、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、苯丙氨酸、脯氨酸、苏氨酸、缬氨酸含量大小依次为发酵虾片组>小球藻藻粉组>酵母组(P<0.05)。发酵虾片组的卤虫幼体的氨基酸总量和必需氨基酸总量均最高,大小均依次为发酵虾片组>小球藻藻粉组>酵母组(P<0.05)。
表3 卤虫无节幼体和经3种饵料养殖的卤虫幼体氨基酸组成及含量(干物质)
Tab.3
| 氨基酸 Amino acids | 卤虫无节幼体 Artemia nauplii | 酵母 S.cerevisiae | 小球藻藻粉 Powder of C.pyenoidosa | 发酵虾片 Fermented shrimp flake |
|---|---|---|---|---|
| 丙氨酸 Ala | 3.34±0.020d | 4.50±0.065c | 5.29±0.047b | 5.62±0.057a |
| 精氨酸Arg# | 3.86±0.022d | 4.64±0.036c | 4.94±0.076b | 5.35±0.050a |
| 天门冬氨酸 Asp | 4.89±0.036d | 6.74±0.078c | 6.99±0.100b | 7.26±0.079a |
| 谷氨酸 Glu | 7.57±0.033d | 9.94±0.115c | 10.36±0.111b | 11.20±0.115a |
| 甘氨酸 Gly | 2.90±0.018d | 4.09±0.054c | 4.27±0.043b | 4.54±0.044a |
| 组氨酸 His# | 1.22±0.011d | 1.50±0.018c | 1.64±0.033b | 1.74±0.012a |
| 异亮氨酸 Ile# | 2.67±0.018d | 3.43±0.056c | 3.69±0.050b | 3.92±0.053a |
| 亮氨酸 Leu# | 3.84±0.019d | 5.03±0.075c | 5.27±0.081b | 5.69±0.072a |
| 赖氨酸 Lys# | 4.60±0.032d | 5.21±0.065c | 6.05±0.079b | 6.22±0.051a |
| 蛋氨酸 Met# | 1.07±0.059b | 1.60±0.064a | 1.49±0.354a | 1.69±0.060a |
| 苯丙氨酸 Phe# | 2.44±0.025d | 3.19±0.023c | 3.51±0.040b | 3.65±0.024a |
| 脯氨酸 Pro | 2.62±0.028d | 3.41±0.078c | 3.58±0.053b | 3.89±0.068a |
| 丝氨酸 Ser | 2.90±0.022c | 3.81±0.054b | 4.17±0.071a | 4.18±0.050a |
| 苏氨酸 Thr# | 2.57±0.015d | 3.52±0.036c | 3.85±0.041b | 4.03±0.036a |
| 酪氨酸 Tyr | 2.39±0.028c | 2.99±0.054ab | 3.03±0.122a | 2.89±0.035b |
| 缬氨酸 Val# | 3.18±0.029a | 4.30±0.021a | 4.61±0.045a | 4.78±0.034a |
| 胱氨酸 Cys | 0.68±0.026b | 0.85±0.032a | 0.86±0.009a | 0.86±0.006a |
| 色氨酸 Trp# | 0.41±0.006c | 0.52±0.008b | 0.54±0.009a | 0.51±0.018b |
| 总氨基酸 TAA | 53.15±0.313d | 69.26±0.851c | 74.14±1.254b | 78.02±0.801a |
| 必需氨基酸 EAA | 25.86±0.275d | 32.94±0.465c | 35.58±0.429b | 37.58±0.584a |
| 必需氨基酸/总氨基酸EAA /TAA | 48.65 | 47.56 | 48.00 | 48.17 |
注:#为必需氨基酸;TAA.总氨基酸;EAA.必需氨基酸。
Notes:# meant essential amino acids;TAA.Total amino acids ; EAA.Essential amino acids.
2.5 不同饵料组卤虫幼体脂肪酸组成及含量
卤虫无节幼体和经3种饵料养殖的卤虫幼体的脂肪酸组成及含量见表4。在卤虫无节幼体中检测到9种脂肪酸,其他组均缺少豆蔻酸。总脂肪酸、不饱和脂肪酸和单不饱和脂肪酸含量大小依次为卤虫无节幼体>发酵虾片组>酵母组>小球藻藻粉组(P<0.05)。
表4 卤虫无节幼体和经3种饵料养殖的卤虫幼体脂肪酸组成及含量(干物质)
Tab.4
| 脂肪酸 Fatty acids | 卤虫无节幼体 Artemia nauplii | 酵母 S.cerevisiae | 小球藻藻粉 Powder of C.pyenoidosa | 发酵虾片 Fermented shrimp flake |
|---|---|---|---|---|
| 豆蔻酸 C14:0 | 2.73±0.163 | — | — | — |
| 棕榈酸 C16:0 | 16.91±0.319a | 8.16±0.228d | 9.38±0.123c | 11.83±0.141b |
| 硬脂酸 C18:0 | 6.17±0.384c | 6.92±0.456b | 5.35±0.189d | 8.26±0.430a |
| 棕榈油酸 C16:1n-7 | 11.81±0.281a | 4.98±0.311b | 4.40±0.071c | 3.85±0.215d |
| 油酸 C18:1n-9 | 28.01±1.625a | 17.56±0.456b | 14.36±0.189c | 26.76±0.373a |
| 亚油酸 C18:2n-6 | 4.22±0.268b | 2.69±0.149c | 2.59±0.214c | 9.77±0.215a |
| 亚麻酸 C18:3n-3 | 11.24±0.221a | 3.83±0.311c | 4.61±0.257b | 3.05±0.215d |
| 花生四烯酸(ARA) C20:4n-6 | 1.28±0.106b | 1.94±0.299a | 2.00±0.351a | 2.30±0.215a |
| 二十碳五烯酸(EPA) C20:5n-3 | 13.79±0.221a | 5.97±0.299c | 6.79±0.123b | 5.02±0.215d |
| 总脂肪酸 TFA | 96.17±3.298a | 52.04±2.463c | 49.49±0.583d | 70.85±1.568b |
| 饱和脂肪酸 SFA | 25.82±0.798a | 15.07±0.684c | 14.73±0.285c | 20.09±0.407b |
| 不饱和脂肪酸 UFA | 70.35±2.637a | 36.97±1.793c | 34.76±0.311d | 50.75±1.278b |
| 单不饱和脂肪酸 MUFA | 39.82±1.874a | 22.54±0.746c | 18.77±0.214d | 30.61±0.533b |
| 多不饱和脂肪酸PUFA | 30.53±0.767a | 14.43±1.048c | 15.99±0.143c | 20.14±0.784b |
| 高不饱和脂肪酸HUFA | 15.07±0.809a | 7.92±1.153c | 8.79±0.123b | 7.32±0.562c |
注:表中“—”表示未检出;TFA.总脂肪酸;SFA.饱和脂肪酸;UFA.不饱和脂肪酸;MUFA.单不饱和脂肪酸;PUFA.多不饱和脂肪酸;HUFA.高不饱和脂肪酸。
Notes:“—” indicated not detected;TFA.Total fatty acids; SFA.Saturated fatty acids; UFA.Unsaturated fatty acid; MUFA.Monounsaturated fatty acids; PUFA.Polyunsaturated fatty acids; HUFA.High unsaturated fatty acid.
小球藻藻粉组卤虫幼体的亚麻酸和EPA含量分别为(4.61±0.257)、(6.79±0.123)mg/g,均显著高于酵母组和发酵虾片组(P<0.05);酵母组卤虫幼体的棕榈油酸含量为(4.98±0.311)mg/g,显著高于小球藻藻粉组和发酵虾片组;发酵虾片组卤虫幼体的油酸和亚油酸含量分别为(26.76±0.373)、(9.77±0.215)mg/g,均显著高于酵母组和小球藻藻粉组(P<0.05);高不饱和脂肪酸含量大小依次为卤虫无节幼体>小球藻藻粉组>酵母组>发酵虾片组。
3 讨论
3.1 饵料对卤虫幼体生长和存活的影响
卤虫因生活环境的不同而具有独特的特性,不同产地(品系)的卤虫卵径、无节幼体体长和营养组成存在明显差异[19],一般高海拔地区卤虫卵径大、颜色较深,孵化的无节幼体个体也较大[20-21];较高的温度环境的卤虫卵径较小、无节幼体也较小[22]。本研究所用的卤虫卵的产地为山东,孵化的卤虫无节幼体平均体长为(404.15±18.81)μm,明显小于西藏4个盐湖产的卤虫无节幼体(519.6~601.1 μm)[8],但与山东潍坊产地的卤虫无节幼体(415.8±23.6 μm)[23]和渤海湾盐田[(350.10±21.44)μm][12]相当,而同一产地的卤虫卵和无节幼体大小的差异可能与孤雌和两性品系混杂卤虫卵有关[23]。
酵母、小球藻藻粉和发酵虾片是卤虫养殖中常用的饵料,这3种饵料均能满足卤虫无节幼体生长的需求。在用盐藻、酵母、麸皮3种饵料培养卤虫的试验中发现,酵母组卤虫的生长和存活率均最低[24];利用不同饵料养殖南京丰年虫(Chirocephalus nankinensis Shen)的结果也表明,酵母养殖的南京丰年虫存活率较低[25]。本研究中卤虫无节幼体平均成活率为79.17%~86.87%,其中发酵虾片组和小球藻藻粉组的卤虫幼体存活率显著高于酵母组(P<0.05),原因可能是酵母菌群促进了培养水体中有机物质含量的增加,导致水质败坏,从而降低了卤虫的存活率[26],这在轮虫等滤食性生物培养中也有相似的结果[27-28]。卤虫生长还与其获取的饵料大小、营养等有关,有研究认为卤虫生长与饵料中蛋白质的含量呈正相关[29]。本养殖试验中各组卤虫幼体平均体长为1 070.75~1 234.54 μm,而发酵虾片组卤虫幼体的生长显著优于酵母组和小球藻藻粉组(P<0.05),小球藻藻粉组卤虫幼体的生长与酵母组差异不显著(P >0.05),这与饵料中蛋白质含量差异基本一致(发酵虾片粗蛋白45.2%、酵母粗蛋白40.0%、小球藻藻粉粗蛋白40.6%)。
3.2 卤虫基本营养成分比较分析
蛋白质和脂肪含量是评价水产动物饵料营养价值的重要指标[30]。本研究中3种饵料投喂的卤虫幼体的粗蛋白含量为63.19%~67.68%、粗脂肪含量为8.65%~10.44%,均有较高的营养价值,可以满足水产动物的生长需求。通过跟踪不同饵料下卤虫总脂肪含量变化的结果,发现随着卤虫幼体体长的增长,总脂肪含量呈现降低趋势[31]。本研究中粗脂肪含量的变化情况也类似,初孵卤虫无节幼体的粗脂肪含量为(11.93±0.033)%,显著高于3种饵料投喂的6日龄卤虫幼体(P<0.05)。以小球藻藻粉和发酵虾片投喂的卤虫幼体粗蛋白和粗脂肪含量要明显高于以酵母喂养的(P<0.05),这与张登沥等[24]的研究结果相似,相对单独的酵母,单细胞藻类和发酵产品更适合作为卤虫高密度培养的饵料。
3.3 不同饵料对卤虫幼体氨基酸含量的影响
水产动物对蛋白质的需要量实际是对必需氨基酸和非必需氨基酸比例的需要,动物饵料中必需氨基酸总量应不低于粗蛋白的1/3[32],鱼虾类限制性氨基酸通常是精氨酸、蛋氨酸、赖氨酸和苯丙氨酸[33],特别是对精氨酸的需求达到3.3%~6.8%[34-35]。本研究中卤虫无节幼体和3个饵料组卤虫幼体的氨基酸含量占干物质的53.15%~78.02%,必需氨基酸与氨基酸总量比值为47.56%~48.65%,均超过40%,精氨酸占比为3.34%~5.62%,能够满足水产动物对蛋白质的需求。通过对比卤虫无节幼体和3个饵料组卤虫幼体的氨基酸含量,发现6日龄卤虫幼体在氨基酸和必需氨基酸总量上均有显著提高,特别是发酵虾片组和小球藻藻粉组显著高于酵母组(P<0.05)。但用小球藻和三角褐指藻(Phaeodactylum tricornutum)强化培养5~7 d的卤虫无节幼体的氨基酸总量和必需氨基酸总量却都小于初孵的卤虫无节幼体[16],这可能是新鲜的小球藻因有完整的细胞壁而不易被消化,而本研究采用小球藻藻粉,其大部分细胞壁已被破碎,有利于卤虫的营养吸收[36]。
3.4 不同饵料对卤虫幼体脂肪酸含量的影响
卤虫卵和卤虫无节幼体中脂肪酸含量受产地影响很大,通常与所处的水环境因子和饵料的脂肪酸组成密切相关[37]。西藏4个盐湖卤虫无节幼体含有较高的 二十二碳六烯酸(DHA)[8];在对不同卤虫幼体脂肪酸的测定中,结果也发现西藏双湖卤虫卵和卤虫幼体中花生四烯酸(ARA)、二十碳五烯酸(EPA)和DHA显著高于其他产地卤虫幼体[12]。对6个产地(3个为沿海盐场、3个为内陆盐湖)卤虫无节幼体脂肪酸的组成分析发现,其含有丰富的EPA,但均未检测到DHA[7]。本研究也有类似的结果,试验中卤虫卵来源于山东沿海盐场,卤虫无节幼体也未检测到DHA。分析西藏地区卤虫含有较高的DHA的原因,可能与强烈的紫外线照射、极低的水温及水体中浮游植物和微生物含有较高的EPA和DHA含量有关[8,12]。
脂肪酸对鱼类和虾蟹类具有重要的作用,但是它们往往不能够自行合成多不饱和脂肪酸,特别是高不饱和脂肪酸(HUFA)[38],饵料中高HUFA 含量和高 DHA/EPA比值有利于鱼类和虾蟹类的存活和生长发育[39],因此在卤虫生产中,通常添加不饱和脂肪酸的饵料或添加剂来营养强化卤虫[40],例如通过鱼油和裂殖壶藻(Schizochytrium)进行的短期营养强化,可显著提高卤虫HUFA含量。采用不同微藻强化卤虫,发现小球藻基本不能提高拟成虫期卤虫的DHA含量,但可以促进卤虫幼体生长和EPA的积累[41];此外,小球藻等饵料不能提高卤虫幼体的蛋白质含量[16]。小球藻作为卤虫的生物饵料,含有丰富的蛋白质和不饱和脂肪酸含量,特别是含有较高的EPA、不含或者少量含有DHA[42⇓-44]。虾片是对虾苗种微粒饲料,具有丰富的氨基酸、脂肪酸组成[45-46],其发酵产物在生物饵料培养中起到重要的肥水作用。本试验中,发酵虾片组总脂肪酸含量和多不饱和脂肪酸含量显著高于小球藻藻粉组和酵母组,但是小球藻藻粉投喂的卤虫幼体的HUFA、EPA含量明显高于酵母组和发酵虾片组,表明发酵虾片和小球藻藻粉相对于酵母具有卤虫营养强化的优势,可用于卤虫的养殖生产。
参考文献
Review of the biogeography of the genus Aretmia (Curstacea,Anostraca)
[J].In this study, we report on the known Artemia habitats worldwide. Recent literature information is incorporated about the taxonomic status of the various populations studied. The genus is composed of di‐, tri‐, tetra‐ and pentaploid parthenogenetic populations and of the following bisexual species: A. franciscana franciscana, A. franciscana monica, A. franciscana sp., A. persimilis, A. salina, A. urmiana, A. sinica and A. sp. from Kazakhstan. The problems of characterizing new brine shrimp populations are discussed. In view of the great importance of Artemia as part of the live food chain for the culture of fish and shellfish larvae and the present cyst shortage from the market, the need for commercial exploitation and development of new Artemia sources is now, more than ever, necessary.
The history,present status and prospects of the availability of Artemia cysts for aquaculture
[J].
5-Rotifers,Artemia and copepods as live feeds for fish larvae in aquaculture
[J].
Review on integrated production of the brine shrimp Artemia in solar salt ponds
[J].
Producing juvenile Artemia as prey for Octopus vulgaris paralarvae with different microalgal species of controlled biochemical composition
[J].
Effect of different supplemental feeds on proximate composition and Artemia biomass production in salt ponds
[J].
Variation in fatty acid composition of Artemia salina nauplii enriched with microalgae and baker’s yeast for use in larviculture
[J].The high content of the essential fatty acids in some microalgae and baker's yeast has made them excellent diets for boosting the fatty acid content of livefood Artemia. The influences of baker's yeast (Saccharomyces cerevisiae) and three microalgae, viz., Chlorella salina, Chaetoceros calcitrans, and Nannochloropsis salina, were tested as diet components in marine livefeed brine shrimp Artemia salina nauplii to improve the polyunsaturated fatty acid (PUFA) composition. Artemia nauplii submerged in these diets for four different enrichment intervals (3, 6, 8, and 24 h) were found to incorporate essential fatty acids, and the percentage composition of different fatty acids was measured in the enriched Artemia nauplii and enrichment diets. N. salina produced higher levels of arachidonic acid (AA, 20:4n6, 9.50%), eicosapentaenoic acid (EPA, 20:5n3, 25.80%), and docosahexaenoic acid (DHA, 22:6n3, 4.18%) as compared to other diets. The total PUFA content of the enriched Artemia by N. salina increased by 56.50% with enrichment periods up to 8 h, followed by a significant reduction in the final 24 h. N. salina yielded Artemia nauplii with considerable EPA (8.05%), AA (14.15%), and DHA (1.85%) after 8 h of enrichment, which are significantly higher levels than in nauplii fed with the other three diets (p = 0.05). The DHA/EPA values in Artemia enriched for 6 h by N. salina and C. calcitrans were found to be, respectively, 88.46 and 25% higher than freshly hatched Artemia. Artemia enriched by C. salina and baker's yeast exhibited a reduction in PUFA content even at 6 h of enrichment. Significant relative decreases in DHA, EPA, and total PUFA in Artemia enriched with all of the diets were apparent, with a corresponding increase in the total saturated fatty acid content (26.95 +/- 9.75%) in the final stages (24 h) of enrichment (p = 0.05).
Manual on the production and use of live food for aquaculture
[R].
Characterisation of high-altitude Artemia populations from the Qinghai-Tibet Plateau,PR China
[J].
Genetic and reproductive differentiation of Artemia franciscana in a new environment
[J].
Important prey species of marine vertebrate predators in the northwest Atlantic:proximate composition and energy density
[J].
Dietary amino acid profiles and growth performance in juvenile kuruma prawn Marsupenaeus japonicus
[J].
Increasing cyst yields in Artemia culture ponds in Vietnam:the multi-cycle system
[J].
Regulation of growth,antioxidant capacity,fatty acid profiles,hematological characteristics and expression of lipid related genes by different dietary n-3 highly unsaturated fatty acids in juvenile black seabream (Acanthopagrus schlegelii)
[J].